 2
2 3
4
3
4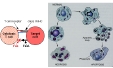 5
5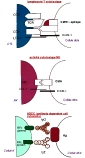 6
6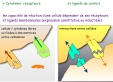 7
7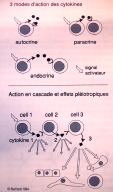 7b
7b 8
8 9
9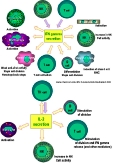 9b
9b 10
10 11
11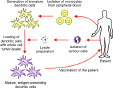
| accueil | immun 1-08: Cellules de l'immunité: identification/étude; cytokines et communication interC ; activités cytotoxiques |
<-- cours --> |
objectifs pédagogiques (*) - effectuer une synthèse des cours! |
|
|
- lister les types de cellules immunocompétentes: identifier pour chacun la distribution normale et les principales fonctions ; décrire les principes du chimiotactisme et de la diapédèse. | |
définitions générales - messages |
|
| leucocytes | = littéralement "cellules blanches", par opposition aux cellules rouges du sang (parce que la centrifugation du sang hépariné sépare ces cellules en une couche blanche au dessus du culot composé d'hématies et de plaquettes). Les leucocytes sanguins comprennent 3 populations principales (les autres cellules étant en quantité très faible) (tab1: principales cellules immunocompétentes): - les lymphocytes - les monocytes - les granulocytes : neutrophiles, éosinophiles, basophiles. Ces cellules interviennent ± dans les nombreux mécanismes inflammatoires, anti-infectieux, anti-parasitaires, anti-tumoraux. Les activités cytotoxiques contre diverses cibles sont résumées dans le tableau 2 : (principaux mécanismes cytotoxiques). |
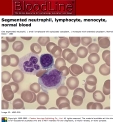
| La numération-formule est une méthode de comptage des leucocytes sur un frottis (ou par un automate): elle permet d'étudier le nombre et la proportion des différentes populations cellulaires: certaines variations peuvent donner des indications cliniques (éosinophilie: parasitose; neutrophilie: infection bactérienne..). Toutefois, la numération par automate ne renseigne pas sur de possibles anomalies morphologiques ou fonctionnelles ; le frottis sanguin permet lui une analyse morphologique mais le comptage est peu fiable. (fig2: frottis sanguin,; tab3: exemple de NF) |
|
| PBMC | ="Peripheral blood mononuclear cells"= ensemble des leucocytes mononucléés du sang (lymphocytes + monocytes essentiellement). Un grand nombre de mécanismes immunologiques (in vivo et in vitro) nécessitent la présence conjointe des lymphocytes et monocytes (ces derniers agissent comme cellules présentatrices d'antigène). La prolifération in vitro des lymphocytes seuls dans un test TTL est très inférieure à celle obtenue avec le mélange lymphocytes-monocytes. |
| capacités cytotoxiques de la réponse immune | La réponse immunitaire est capable de détruire des cibles (bactéries, parasites, cellules anormales..) de façon ± efficace, ± ciblée. |
| Les 2 principaux mécanismes cytotoxiques pour les cellules anormales (infectées, tumorales), sont : - la cytolyse (provoquant la nécrose tissulaire, et donc ± dommages tissus adjacents et inflammation) - l'apoptose (peu de dommage aux cellules adjacentes) |
|
| cytolyse | = mécanisme de destruction cellulaire par libération ou sécrétion de composés toxiques au contact de la cible (fig3: vidéo cytolyse) : - radicaux libres, nitrites et dérivés de l'O2 provoquant la destruction de la membrane (générateur de dommages tissulaires importants) - enzymes, modificateurs du pH et complexes générateurs de pores membranaires (CAM, perforines, granzymes..) provoquant la mort par désorganisation des échanges. |
| ADCC | = Antibody Dependent Cell Cytotoxicity = mécanisme de cytolyse médié par les anticorps, réalisé par certaines cellules appellées "cellules K=Killer" qui possèdent des RFc et des capacités cytotoxiques (la cible est reconnue par ses antigènes de surface). L'ADCC est réalisée principalement par les éosinophiles. ( fig5: mécanismes cellulaires cytotoxiques) |
| apoptose | = "mort cellulaire programmée" = mécanisme d'auto-destruction cellulaire par fragmentation de l'ADN, due à la transduction de signaux membranaires aux endonucléases. L'apoptose est un mécanisme fréquent dans l'organisme, durant l'embryogénèse et durant tout renouvellement ou remaniement tissulaire (de nombreuses cellules tissulaires « vieillissantes » ne répondent plus aux cytokines et facteurs de croissance et meurent d’apoptose). Certaines cellules anormales (tumorales, infectées..) peuvent exprimer en même temps que des antigènes anormaux des récepteurs inductibles (R-TNF/TNF, ligand Fas..) qui les rendent sensibles à l’activité cytotoxique des lymphocytes T et NK spécifiques. (sans dommages pour les tissus adjacents). (fig4: apoptose NK-dépendante , fig5: mécanismes cellulaires cytotoxiques) |
| CD | = "cluster of differenciation""= système de classement des cellules immunocompétentes en groupes définis par l'expression d'un même antigène reconnu par un anticorps de référence (le plus souvent il s'agit d'un anticorps monoclonal). Plus de 250 CD ont été recensés dans des consensus scientifique international, en médecine humaine et vétérinaire; les anticorps correspondants (« antiCDxx ») sont disponibles pour le diagnostic et la recherche chez l'homme, la souris de laboratoire et pour certaines espèces animales. Les CD peuvent être détectés principalement par immunohistochimie ou par cytométrie de flux (tab5: exemples de CD, fig3: cytometrie de flux) |
| Beaucoup de ces CD (mais pas tous) correspondent à des molécules ou complexes maintenant identifiés sur le plan structural et/ou fonctionnel (récepteurs, facteurs d'adhésion..). L' expression des CD à la surface des différentes cellules immunocompétentes caractérise des sous-populations cellulaires fonctionnelles, au delà de l'identification phénotypique : cela permet d'étudier leur état d'activation et de différenciation (beaucoup de ces CD sont inductibles: leur niveau d'expression varie); l'étude des CD est par exemple utilisée pour l'identification du type cellulaire d'une tumeur. |
|
| communication intercellulaire | Les cellules immunocompétentes communiquent beaucoup, provoquant de nombreuses fonctions. La majorité des interactions ont lieu entre elles, mais elles peuvent également interagir avec des cellules des tissus environnants (endothélium vasculaire: diapédèse..). On distingue plusieurs types de communication des cellules immunocompétentes (fig6: interactions par contact et à distance): - interactions par contact entre cellules adjacentes, par l'intermédiaire de paires de ligands qui permettent aux cellules de déterminer leur type et leur état d'activation. - interactions entre cellules immunocompétentes adjacentes ou lointaines par l'intermédiaire de cytokines (et récepteurs correspondants) - interactions par contact avec les matrices extracellulaires, par l'intermédiaire de paires de ligands qui permettent aux cellules de modifier leur état d'activation en fonction du tissu où elles se situent. - sensibilité aux hormones et neuro-médiateurs produits par d'autres systèmes de l'organisme. |
| cytokines | cf "cytokines" dans cours immun1-02: protéines impliquées dans la communication des cellules immunocompétentes. On connait plus de 140 cytokines, regroupées en famille selon leur fonctions ou le type de cellules productrices; les cytokines agissent à très faible dose selon des principes similaires aux hormones protéiques; il existe d'importants mécanismes de régulation dans la production des cytokines et dans la sensibilité des cellules aux cytokines (expression inductible des récepteurs). Beaucoup de cytokines ont plusieurs activités // (fig7: généralités sur l'action des cytokines), et certaines cytokines agissent sur d'autres systèmes de l'organisme: hypothalamus/fièvre, TNF/métabolisme... (fig8: exemple des cytokines produites par les macrophages) On distingue: - cytokines pro-inflammatoires (IL1, IL6, IL8, IL11, IL12, TGF-beta, TNFs, IFNs..) et pyrogènes (IL1, IL6, TNF alpha) - interférons (distinguer les IFN de type 1 et l'interféron gamma) (fig9: exemple des activités de l'IL2 et de l'IFN gamma et fig9b: exemple de traitement antiviral par IFN de type 1) - cytokines ayant une activité cytolytique (TNF..) - cytokines régulatrices de l'activité, de la prolifération et de la différenciation des lymphocytes - cytokines régulatrices de l'homéostasie des leucocytes (en situation normale ou en réponse à l'infection) - autres cytokines (chimiotactiques=chemokines, inductrices de vascularisation/cicatrisation..) |
| IL (interleukine) | interleukines= ensemble de cytokines produites par les cellules immunocompétentes, nommées successivement IL1 à IL30 ; il s'agit d'un groupe hétérogène constitué au fur et à mesure de leur découverte. |
| CSF | = "colony stimulating factors" = ensemble de cytokines de la prolifération, intervenant dans la régulation du nombre des leucocytes. On distingue plusieurs CSF actifs sur les monocytes, les granulocytes.. |
| TNF | = Tumor necrosis factors"= ensemble de cytokines possédant à la fois des activités cytolytiques par induction d'apoptose, des activités pro-inflammatoires et régulatrices de l'immunité. Leur rôle a été découvert par leur action cytolytique de nombreuses tumeurs in vitro. La cytolyse s'exerce sur toute cellule reconnue comme anormale, qui en plus exprime le recepteur R-TNF (normalement réprimé, il est induit lors d'inflammation ou dans certaines pathologies). La cytolyse se fait surtout par induction d''apoptose (forme de cytolyse auto-organisée par la cellule après fragmentation du noyau). Les TNF sont impliqués dans les complications graves des infections et des tumeurs lors de surproduction par l'organisme (syndrome de choc septique...). (fig10: actions du TNF selon la dose) |
| TGF | = "Transforming Growth Factors"= ensemble de cytokines intervenant dans la prolifération cellulaire, la vascularisation et la cicatrisation des tissus. Certains TGF sont également des régulateurs de la réponse immune, le plus souvent inhibiteurs. Les TGF sont impliqués dans la physiopathologie cancéreuse. |
schémas et figures |
|
tableaux |
tableau 1: les cellules immunocompétentes des mammifères (cf histologie) |
groupe | type | sous-populations | distribution principale | caractéristiques / fonctions |
| cellules "mononuclées" (noyau en un seul tenant) (=PBMC dans le sang) | lymphocytes | lymphocytes B (expression du BCR) | du lymphocyte B immature au plasmocyte | organes lymphoïdes >> sang et lymphe > muqueuses et tissus (les lymphocytes présents dans le sang sont des formes matures intermédiaires: on trouve peu ou pas de lymphoblastes et pas de plasmocytes) |
les lymphocytes se caractérisent par le maintien dans les cellules matures d'importantes capacités de prolifération-dédifférenciation-différenciation, en réponse aux stimulations antigéniques et aux cytokines: - les lymphoblastes sont des formes dédifférenciées capables de proliférer (augmentation du nombre des clones spécifiques en réponse à l'antigène) - les lymphocytes matures présentent différents stades de différenciation ; les plasmocytes sont des formes différenciées de lymB capables de produire de grandes quantités d'anticorps. |
| lymphocytes T (expression du TCR) | sous populations T CD4, T CD8..) | ||||
| lymphocytes NK | |||||
| système des phagocytes mononucléés | monocyte-macrophage | monocyte: forme sanguine et immature; macrophage: forme tissulaire mobile | tissus > organes lymphoïdes (les monocytes circulent dans le sang et la lymphe) | phagocytose /opsonisation | |
| autres phagocytes tissulaires | nombreuses cellules propres à chaque tissu | ||||
| cellules "polynucléées" = granulocytes (noyau en plusieurs segments) | neutrophiles | sang et réservoirs >> tissus | phagocytose/opsonisation | ||
| éosinophiles | tissus >> sang | activité cytotoxique et inflammatoire (dégranulation) | |||
| basophiles | sang principalement | activité inflammatoire (dégranulation) | |||
| mastocytes | plusieurs types (dans les conjonctifs et les muqueuses) | tissus | activité inflammatoire (dégranulation) | ||
| cellules dendritiques | plusieurs types | tissus, organes lymphoïdes et lymphe | principales cellules présentatrices des antigènes (phagocytent les particules et micro-organismes dans les tissus et les transportent aux organes lymphoïdes secondaires) | ||
| d'autres cellules, dites "accessoires", interviennent pour compléter les réactions immunes en participant à l'inflammation, au chimiotactisme, à la coagulation: plaquettes, cellules endotheliales.. | |||||
Tableau 2: mécanismes de cytotoxicité |
acteurs | cibles | principe | |
| mécanismes acellulaires | protéines anti-microbiennes (lyzozyme..) | production par des types cellulaires divers (muqueuses..) | bactéries sensibles | selon molécule (lyzozyme= lyse paroi gram+..) |
| complexe d'attaque du complément | bactéries gram-, virus enveloppés.. | formation de pores membranaires sur des cibles activant le complément | ||
| apoptose | lymphocytes T ou NK producteur d'un signal d'apoptose (TNF, Fas); cellules tissulaires productrices de TNF | cellule exprimant un récepteur pour un signal d'apoptose (R-TNF ou FasL); l'expression du R est régulée | auto-destruction des cellules anormales (infectées, tumorales..), par fragmentation de l'ADN | |
| cytolyse | lymphocytes T ou NK (et quelques autres types cellulaires) | cellules reconnues (reconnaissance antigénique ou anomalie d'expression du CMH) | formation de pores membranaires (perforines, granzyme..) et/ou sécrétion de protéines toxiques (enzymes, modificateurs du pH..) | |
| ADCC (antibody dependent cell cytotoxicity) | "cellules K (killer)": principalement éosinophiles, et quelques autres types cellulaires | parasites (protozoaires et helminthes) et cellules; les cibles sont reconnues par des anticorps (activation des RFc par des IgG ET des IgE). | sécrétion/dégranulation de molécules toxiques (radicaux libres et dérivés de l'O2, enzymes, modificateurs du pH..) | |
| phagocytose | phagocytes (neutrophiles, macrophages..) | bactéries, protozoaires et petites cellules (hématies..); ; la phagocytose est amplifiée par l'opsonisation (meilleure reconnaissance des cibles). |
ingestion et destruction de cibles sensibles à la phagocytose (radicaux libres et dérivés de l'O2, nitrites, enzymes contenus dans les lysosomes). | |
tableau 4: principales cytokines (cf site BD) |
principales cellules productrices (après stimulation par..) | principales cellules cibles (stimulus nécessaire pour sensibilité cytoines/expression du récepteur) | effets |
| IL1 | macrophages, cellules tissulaires (signaux de danger) | très nombreuses cellules | cytokine pyrogène et inflammatoire; induit l'expression de R-IL2 sur les lymphocytes (premier temps de l'activation lymphocytaire) |
| IL2 | lymphocytes T (Ag) et NK | lymphocytes T (Ag) et B (Ag), et NK | activation de la prolifération et de la différenciation des lymphocytes en présence de l'Ag |
| IL3 | lymphocytes T (Ag) | cellules souches | contrôle de l'homéostasie leucocytaire |
| IL4 | lymphocytes T (Ag) mastocytes |
lymphocytes T (Ag) et B (Ag) basophiles, mastocytes, éosinophiles |
régulation de la différenciation des lymphocytes en présence de l'Ag; contrôle de l'activité cytotoxique et inflamamatoire des granulocytes (effets modulés selon les ratios IL4/IL5/IL13/IFNgamma..) cf régulation |
| IL5 | |||
| IL6 | macrophages, cellules tissulaires (signaux de danger) | lymphocytes cellules du SNC et des vaisseaux |
cytokine pyrogène et inflammatoire (inductrice des protéines de la phase aigue de l'inflammation produites par le foie) |
| IL7 | cellules souches | cellules souches | contrôle de l'homéostasie leucocytaire |
| IL8 | cellules immunocompétentes (signaux de danger) | cellules immunocompétentes | chimiotactisme, diapédèse (attraction des neutrophiles au site d'une infection..) remarque: nombreuses cytokines apparentées à l'IL8 ou possédant des effets similaires |
| IL9 | lymphocytes T (Ag) | basophiles, mastocytes | renouvellement et activation des basophiles et mastocytes |
| IL10 | lymphocytes T (Ag) monocytes |
lymphocytes T(Ag) et B (Ag) | inhibition de la prolifération et de la différenciation des lymphocytes en présence de l'Ag |
| IL11 | propriétés identiques IL6 | ||
| IL12 | cellules dendritiques et macrophages (signaux de danger) | lymphocytes T (Ag) | action similaire IL2: activation de la prolifération et de la différenciation des lymphocytes en présence de l'Ag |
| IL13 | lymphocytes T (Ag) | nombreuses cellules | modulation de la réponse aux signaux de danger et aux IL |
| IL17 | lymphocytes T (Ag) | nombreuses cellules | régulation de l'inflammation (la sous-population LT CD4 Th17 est la principale productrice d'IL17). |
| IFN gamma | lymphocytes T (Ag) et NK | lymphocytes T (Ag) et NK macrophages |
activation de l'immunité cellulaire (cytotoxicité, explosion respiratoire, production de cytokines et différenciation) |
| IFN alpha et beta | cellules tissulaires (infection virale) | cellules tissulaires adjacentes | protection anti-virale ; activation des cellules dendritiques (signal de danger) |
| TNF alpha | monocytes-macrophages (signal de danger) | lymphocytes T(Ag) et NK cellules tissulaires (expression R si anomalie: apoptose) cellules du SNC et des vaisseaux |
activation de l'immunité cellulaire (cytotoxicité, apoptose, production de cytokines et différenciation); activité anti-tumorale et anti-virale (apoptose) cytokine pyrogène et inflammatoire |
| TNF beta | lymphocytes T (Ag) | ||
| TFG beta | cellules tissulaires (signaux de danger) | cellules tissulaires adjacentes | contrôle de la prolifération cellulaire et de la cicatrisation (vascularisation, restauration tissulaire/fibrose..); inhibition de l'activité immune |
| CSF (GM-CSF, M-CSF..) | cellules souches et cellules tissulaires | cellules souches | contrôle de l'homéostasie leucocytaire; augmentation du nombre des leucocytes en cas d'inflammation |
| IL14 | lymphocytes T (Ag), c.dendritiques | lymphocytes B (Ag) | contrôle de la différenciation mémoire |
| IL15 | cellules tissulaires (signaux de danger); interface foeto-maternelle (rôle dans l'immunité gestationnelle) |
nombreuses cellules, dont surtout T (Ag) et NK | cytokine inflammatoire, activatrice comme l'IL2 des lymphocytes T et surtout NK; régulatrice des lymphocytes T à TCR gamma-delta; antagoniste TNFalpha |
| IL16 | nombreuses cellules immuno-compétentes | cytokine inflammatoire (fait produire les cytokines pro-inflammatoires par les monocytes-macrophages); inductrice de la production d'IL2, antagoniste IL4 et IL5 | |
| IL18 | même famille que IL1 | ||
| IL19 | |||
| IL20 | |||
tableau 5: exemples de CD identifiés - ne pas apprendre! liste : ici |
CD | fonction | cellules; commentaires |
| molécules associés aux récepteurs TCR et BCR | CD3 | chaine associée au TCR | lymphocytes T (rôle dans la transduction du signal) |
| CD4 | chaine associée au TCR | lymphocytes T (sous-population T CD4); rôle dans la reconnaissance de la voie de présentation de l'antigène | |
| CD8 | chaine associée au TCR | lymphocytes T (sous-population T CD8); rôle dans la reconnaissance de la voie de présentation de l'antigène | |
| CD45 | tyrosine kinase (module la transduction du signal TCR) | leucocytes (lymphocytes T: plusieurs isoformes de CD45 sont exprimés selon l'état de différenciation: phénotype "naïf"/CD45RA et "mémoire "/CD45R0) | |
| CD21 | récepteur pour le complément type 2 (CR2) | lymphocytes B matures | |
| CD28 | chaine de co-stimulation des lymphocytes T | lymphocytes T CD4 ; modulation en fonction du ligand présenté par la cellule présentatrice d'antigène (une CPA exprime B7, dont il existe plusieurs isoformes). En l'absence de l'association CD28-B7, le lymphocyte peut devenir hyporéactif à l'antigène (anergie). D'autres cellules expriment le CD28, compliquant les mécanismes. | |
| récepteurs RFc | CD64 | RFc gamma 1 (IgG) | monocytes-macrophages, neutrophiles (un peu éosinophiles); rôle dans l'opsonisation ++; forte affinité; inductible par IFNgamma; chez l'homme le RFCgamma1 fixe très bien les IgG3, moyennement les IgG1 et IgG4, et très peu les IgG2 |
| CD32 | RFc gamma 2 (IgG) | nombreuses cellules ; faible affinité | |
| CD16 | RFc gamma 3 (IgG) | neutrophiles, éosinophiles, mastocytes, macrophages, NK; faible affinité (macro-complexes Ag-Ac) | |
| RFc epsilon 1 (IgE) | mastocytes, basophiles, éosinophiles, cellules de Langerhans; forte afflinité | ||
| CD23 | RFc epsilon 2 (IgE et autres molécules de l'immunité) | nombreuses cellules; faible affinité; inductible | |
| CD89 | RFc alpha (IgA) | neutrophiles: phagocytose | |
| récepteurs de cytokines | CD25 | chaine alpha du récepteur pour l'interleukine 2 | lymphocytes activés (l'expression du récepteur est inductible: la réaction à l'IL2 est possible quand toutes les chaines du R-IL2 sont exprimées) |
| co-stimulation entre cellules adjacentes | CD40 | fixation au CD40L (=CD28) | cellules présentatrices d'antigène : fixation au lymphocyte T (qui exprime le ligand CD40L=CD28) |
| CD11/CD18 | famille des intégrines (nombreuses isoformes) | leucocytes (interactions avec les cellules endothéliales..) l'isoforme CD11b/CD18 est le RC3b des cellules phagocytaires |
|
| CD52 | famille des intégrines | leucocytes. Des anticorps monoclonaux anti-CD52 sont utilisés en thérapeutique humaine pour détruire les leucocytes (destruction de cellules cancéreuses, prévention du rejet de greffe..) (anticorps monoclonal humanisé: Campath®). |
|
| récepteurs de signaux de danger | CD14 | récepteur pour des substances microbiennes (LPS..) | monocytes-macrophages, cellules dendritiques.. |
élements d'application et de raisonnement |
| Les cellules immunocompétentes sont classés en différents types sur des critères morphologiques (taille et granulosité, aspect du noyau, colorations histologiques..) et en fonction de leur origine (lymphoïde, myéloïde.. fig 1: origine des cellules immunocompétentes); puis subdivisés en sous-populations au sein de ces types sur des critères structuraux (expression de récepteurs et molécules de surface, constituants des granules..) et fonctionnels (participation à l'activité cytotoxique, prodution de cytokines..). |
| Les CD sont très utilisés pour l'identification fine des populations cellulaires): - en recherche (identification des cellules immunocompétentes) - pour le diagnostic des tumeurs (identification du type d'une cellule cancéreuse) et des phénomènes immunopathologiques (suivi HIV..). |
| L'apoptose est un mécanisme très répandu de contrôle des tissus, qui a été découvert récemment car les manifestations cliniques et histologiques sont discretes. De nombreuses cellules expriment R-TNF ou FasL en cas d'anomalie (infection, tumorisation..), ce qui les rend vulnérables au TNF/fas produit par les lymphocytes ou par les tissus lésés. |
| Les capacités cytotoxiques de l'organisme sont très importantes (tab1: principaux mécanismes): - il existe plusieurs mécanismes complémentaires (chacun est caractérisé par des cibles et des acteurs) - une réponse immune spécifique efficace permet d'attaquer précisément les cibles en limitant les dégats "collatéraux" (tandis que les mécanismes non spécifiques sont plus agressifs pour les tissus environnants). |
| la cytolyse est un mécanisme plus fréquent que l'ADCC. La cytolyse est produite principalement par des lymphocytes cytotoxiques: ces lymphocytes différenciés possèdent des lysosomes contenant des composés toxiques. L'ADCC concerne surtout la cytolyse de parasites par des éosinophiles, et dans une moindre mesure la cytolyse de cellules anormales par d'autres types cellulaires (ce dernier mécanisme est limité par des interactions inhibitrices d'ADCC entre cellules). |
| Il faut généralement plusieurs signaux pour activer les fonctions immunes (ce qui assure une régulation fine): - les lymphocytes s'activent en réponse à l'antigène ET aux cytokines - la cytotoxicité par les CTL et les NK dépend de la reconnaissance de la cible ET de paires de molécules membranaires co-stimulatrices qui renforcent la liaison du lymphocyte avec la cellule cible (CD28-CD40, LFA-ICAM..) - il faut réunir plusieurs complexes Ag-Ac pour activer l'ADCC ou pour activer le complément |
| Les cytokines forment un groupe hétérogène, de plus 140 protéines de la communication entre cellules immunocompétentes : - on les regroupe par familles productrices (monokines..), par fonctions (chemokines, CSF..) ou par structure (TNF, TGF..) - leurs actions suivent un schéma commun (fig7: généralités sur l'action des cytokines) : - elles sont produites par un ou plusieurs types cellulaires ("cellules productrices"), après activation cellulaire (fig7b: exemple d'effet en cascade: induction de l'IL2 par les LT répondant aux signaux de danger perçus par les cellules dendritiques via TLR2) - elles agissent sur des cellules cibles qui expriment le récepteur correspondant; l'expression du récepteur est souvent régulée; une cytokine peut avoir plusieurs effets sur des cibles différentes - leur action suit les règles générales des hormones protéiques (action à très faible dose, effet paracrine et endocrine, instabilité, diffusibles..) - leurs effets sont variables selon la cellule cible (type cellulaire, état d'activation et de différenciation) - les cytokines sont redondantes (plusieurs cytokines peuvent avoir des propriétés et des effets similaires) - leurs effets sont fortement modifiés par combinaisons (2 cytokines associées donnent un signal différent de chacune prise isolément) |
| On peut partager schématiquement les cytokines en 2 groupes fonctionnels: - celles qui sont produites par de nombreux types cellulaires en réponse à des signaux non spécifiques (cytokines pro-inflammatoires et pyrogènes, cytokines régulant l'homéostasie leucocytaire). Elles contrôlent la mise en route et l'intensité de la réponse immune non spécifique, et participent à l'activation des lymphocytes (réponse spécifique). - celles qui sont produites par les lymphocytes T en réponse à l'antigène. Elle contrôlent la qualité de la réponse immune spécifique (orientation immunité humorale/cellulaire, classe d'Ig produite..). |
| Il existe maintenant de nombreuses cytokines recombinantes, ce qui facilite considérablement l'étude des mécanismes fondamentaux et immunologiques. Il existe aussi de nombreuses lignées de souris transgéniques ou knock-out (surexprimant ou déficientes en cytokines ou récepteurs de cytokines). L'utilisation in vitro des cytokines permet de maintenir et de maitriser la différenciation des cellules en culture. |
Les recherches fondamentales montrent que la régulation de l'action des cytokines est très fine: |
| L'utilisation thérapeutique des cytokines est une piste prometteuse mais difficile: - les essais chez la souris apportent beacuoup d'informations, mais qui sont difficiles à transposer d'une maladie à l'autre, et d'une espèce à l'autre - l'administration de cytokines dans la circulation générale ne reproduit pas les doses et les effets obtenus localement. La plupart des cytokines sont toxiques par administration générale aux doses nécessaires pour l'action locale (d'où l'intérêt des formulations qui ciblent précisément le site de délivrance ou des traitements des cellules ex vivo avant réimplantation). Actuellement, seuls les interférons de type 1 sont régulièrement utilisés en médecine humaine (traitement de l'hépatite B..) et des IFN de type 1 bovin et félin sont disponibles depuis peu en médecine vétérinaire. - de nombreux essais cliniques sur l'administration d'anticorps anti-cytokines dans des maladies inflammatoires graves de l'homme ont apporté des résultats contradictoires selon les centres d'essais (actuellement sont surtout utilisés des anticorps anti-TNF pour traiter les chocs septiques et certaines maladies auto-immunes..). - l'utilisation d'interférons de type 1 procure des résultats intéressants dans différents essais cliniques vétérinaires. - l'utilisation de cytokines pour moduler l'immunité in vitro avant réimplantation des cellules au patient a montré son efficacité dans de nombreux essais cliniques en cancérologie et greffes. (fig11: principe de l'utilisation thérapeutique ex vivo des cytokines) |
- lister les types cellulaires qu'on trouve normalement dans le sang, dans les tissus, dans les organes lymphoïdes (préciser au niveau des sous-populations morphologiques ou fonctionnelles) .
- attribuer à chaque type cellulaire ses principales caractéristiques (les éosinophiles sont-ils capables de phagocytose ?..) décrire les différents phénomènes de dégranulation.
- comparer les mécanismes d'apoptose, de cytolyse et d'ADCC (cibles, cellules effectrices, conséquences cliniques..)
- établir un schéma récapitulatif des types, de la distribution et du renouvellement des cellules immunocompétentes
- interpréter des exemples simples de cytométrie de flux.
références et cours disponibles |
caractérisation et nombre des cellules immunocompétentes (et numération-formule): cf histologie
pour en savoir plus :
Clusters of Differenciation: http://fr.wikipedia.org/wiki/Cluster_de_différenciation
TNF: http://en.wikipedia.org/wiki/Tumor_necrosis_factors
"molécules membranaires d'adhérence intercellulaire et de signalisation- chapitre 6" in "Immunologie" JP Revillard/ASSIM
I. Kacskovics, Fc receptors in livestock species, Vet. Immunol. Immunopathol. 102 (2004), pp. 351–362.
réalisation et interprétation d'un frottis sanguin coloré au MGG: http://pedagogie.ac-montpellier.fr/Disciplines/sti/biotechn/frottis-sanguin-normal.htm
http://rbml.fr/biologie
page réalisée par le Dr Delphine Grézel, VetAgro Sup, Campus Vétérinaire de Lyon, le 2/02/12 . Merci pour les corrections, commentaires et suggestions ( delphine.grezel@vetagro-sup.fr)