 2
2 3
3 4
4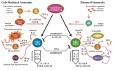 5
5 .
6
.
6 7
7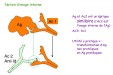 8
8 10
10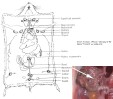 11
11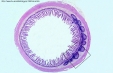 12
12 13
13 14
14 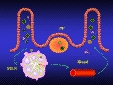 15
15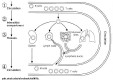 16
16 17
17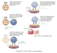
| accueil | immun 1-16: Régulation de l'immunité; Th1-Th2; réponse humorale et cellulaire ; Immunité systémique, locale et muqueuse |
<-- cours --> |
objectifs pédagogiques (*) |
|
|
- décrire schématiquement les mécanismes de régulation quantitative et qualitative de l'immunité et leur intérêt | |
définitions générales - messages |
|
| régulation quantitative de l'immunité | = ensemble des mécanismes conduisant à l'amplification puis à la décroissance de la réponse immune (fig1: schéma général de la réponse immune). De très nombreux mécanismes immuns non spécifiques et spécifiques s’activent au fur et à mesure des stimulations par l’agresseur (endotoxines, antigènes..). La disparition de l’agresseur entraine la diminution progressive des mécanismes immuns (mais en conservant une « fraction mémoire »). Les facteurs de régulation de la réponse immune sont nombreux: - biodisponibilité et immunogénicité de l'antigène (la réponse immune s'arrête dès l'élimination de l’agression; certains antigènes peuvent persister plusieurs semaines et être présenté de façon prolongée dans les organes lymphoïdes secondaires après avoir été amené par les CPA). - nombre et nature des lymphocytes spécifiques (prolifération, différenciation en lymphocytes mémoire). - mécanismes d'entretien de la réponse immune (réactions croisées, réseau idiotypique) - répétition des stimulations par un antigène protéique: les réactions immunes par des immunogènes s'amplifient au cours des stimulations (mise en place d’une réponse anticorps de type secondaire plus rapide et plus intense). |
| Très généralement, la réponse immune spécifique ne revient pas au niveau initial (ni à 0) après le premier contact avec l'Ag : il reste des lymphocytes actifs (circulants/OL2) et des lymphocytes mémoire (stockés) pendant de nombreux mois/années. Aussi, il existe souvent une réponse initiale faible avant la première "vraie" rencontre avec un µorganisme en raison des réactions croisées (flore commensale apparentée..) |
|
| régulation qualitative de la réponse immune (=orientation de la réponse immune) | = ensemble des mécanismes conduisant à favoriser ou inhiber telle ou telle composante de la réponse immune, sous l'influence des coopérations cellulaires et des cytokines (on parle d'orientation de la réponse immune). Une des régulations les plus spectaculaires est la modification de la réponse anticorps, de type primaire en type secondaire (fig2: réponse anticorps primaire et secondaire). |
| L'efficacité protectrice de la réponse immune (anti microbienne, anti tumorale..) dépend à la fois de la régulation quantitative et qualitative: - il existe de très nombreux mécanismes effecteurs qui sont plus ou moins efficaces selon les agressions (anticorps neutralisants/toxine, augmentation de la phagocytose/parasite intracellulaire des macrophages..). La protection maximale est obtenue quand la réponse immune produit les mécanismes effecteurs nécessaires (par exemple les IgA protecteurs des muqueuses ne sont produites qu'au cours d'une réponse de type secondaire). - tous les mécanismes effecteurs ne peuvent être présents en même temps au cours de la réponse immune (ils ont même souvent tendance à s'exclure mutuellement car ce qui favorise un mécanisme peut en inhiber un autre). |
|
| immunité humorale et immunité cellulaire | = distinction historique fondée sur des expériences "princeps" entre 2 groupes de mécanismes de l'immunité (cf tableau 1 immun1-01) - immunité humorale (humeurs= liquide biologique: sang.) : immunité spécifique transférable d'un individu immun à un individu "naïf" par injection du sérum (=mécanismes dépendant des anticorps). L'immunité humorale est à la base du diagnostic sérologique, de la sérothérapie et du transfert maternel de l'immunité. - immunité cellulaire: immunité spécifique non transférable par le sérum (nécessite le transfert de cellules immunocompétentes, ce qui n'est en pratique pas réalisable entre 2 individus qui ne sont pas histo-compatibles). En fait l’immunité cellulaire correspond aux mécanismes cellulaires dépendant directement de la stimulation des lymphocytes T et de leur coopération entre eux et avec et les cellules effectrices (macrophages, NK..). |
| Antigène thymo-indépendant | Normalement, un antigène est dit immunogène, c'est à dire capable de provoquer une réponse immune humorale (secondaire) et cellulaire, lorsqu'il possède à la fois des épitopes T et B. Ces antigènes sont donc des protéines (ou des complexes contenant une partie protéique qui fournit l'épitope T). Ces antigènes sont dit "thymo-dépendants" car la réponse immune est très diminuée en cas d'absence de lymphocytes T (individus athymiques). Il existe cependant des cas où des antigènes non protéiques induisent une forte réponse anticorps, en stimulant plus que la normale les lymphocytes B même en l'absence de lymphocytes T : on parle d'antigènes thymo-indépendants (ils ne donnent pas lieu en revanche à une immunité cellulaire). En fait, ces antigènes présentent des motifs répétés, donc plusieurs fois le même épitope B. La stimulation de récepteurs BCR contigüs par ces multiples épitopes B permet une forte activation du LB, au point de produire une réponse anticorps secondaire (IgG et/ou IgA). Les antigènes thymo-indépendants sont en premier lieu les endotoxines bactériennes, les gangliosides et les polysaccharides complexes ; des polymères artificiels peuvent aussi être des Ag thymo-indépendants. |
| Th1, Th2, Th17, Treg: voir ici ! | = sous-populations fonctionnelles des lymphocytes T CD4 qui contrôlent la réponse immune spécifique. On distingue classiquement des Th1 (favorisent l'immunité cellulaire) et des Th2 (favorisent la production d'anticorps IgA et IgE) : ces populations ont été bien définies dans des modèles expérimentaux et chez l’homme, et étendus à la plupart des espèces domestiques mais leur caractérisation dans d'autres espèces n'est pas complète. D'autres sous-populations ont été décrites, comme les Th17 (modulation de l'inflammation par sécrétion d'IL17) et les Treg, qui ont des effets régulateurs, voire inhibiteurs de la réponse immune (production d'IL10 et de TGF), dans des contextes particuliers. Les paramètres servant à l’identification des sous-populations lymphocytaires TCD4 régulatrices sont: - la production de profils de cytokines caractéristiques (Th1: IFNgamma et IL2; Th2: IL3, IL4 et IL5..) - l'expression de certaines molécules de surface et CD fig5: voies de différenciation des Th1 et Th2 , tableau récapitulatif |
| anergie | = hyporéactivité cellulaire à un stimulus. Les lymphocytes T peuvent devenir anergiques, c'est à dire hyporéactifs à l'antigène: des doses d'antigène et des signaux accessoires beaucoup plus forts que la normale sont requis pour obtenir à nouveau une réponse normale (des lymphocytes anergiques ne réagissent pas à l'antigène, alors que des lymphocytes naïfs répondent!). Il s'agit d'un état de différenciation particulier des lymphocytes, obtenu lors de processus de coopération souvent anormaux, pathologiques (présentation de l'antigène par des cellules immatures, infections terminales..) (fig6: interactions cellulaires: absence de signaux accessoires B7/CD28 au cours de l'anergie) |
| réseau idiotypique | = ensemble des mécanismes de régulation de la réponse anticorps grâce à la production d'anticorps anti-idiotypes dirigés contre les anticorps produits en réponse contre un antigène, puis contre ces anticorps anti-idiotypes . Ce principe un peu « théorique » a conduit en fait à des progrès récents en médecine humaine dans le traitement de maladies du système immunitaire. Un anticorps anti-idiotypique reconnait un épitope formé sur la partie variable d'un anticorps, soit dans le paratope, soit à l'extérieur de ce paratope (cf variations structurales des Ig): chaque anticorps peut donc donner naissance à plusieurs anticorps anti-idiotypiques. Le concept d’image interne permet aux chimistes de produire des peptides à partir du paratope possédant la même conformation que la molécule de départ !(fig7: anticorps anti-idiotypes et "image interne" de l'antigène, fig8: réseau idiotypique). |
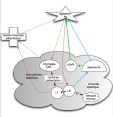
| immunité systémique (=générale) | = réponse immune prolongée et étendue à l'ensemble de l'organisme, mesurable par une réponse anticorps sérique et/ou par la détection d'une réponse spécifique à partir de lymphocytes sanguins (TTL). Cette immunité résulte d'une forte stimulation par un antigène immunogène, initiée par le transport de l'antigène jusqu'à un organe lymphoïde secondaire (rate, noeuds lymphatiques) où se déroule une réponse spécifique puis la circulation dans le sang de lymphocytes spécifiques vers les autres structures immunes. (fig10: principaux noeuds lymphatiques) |
| immunité locale | = immunité cantonnée à un territoire (peau, muqueuses..), qui ne s'étend pas au territoire systémique (ou seulement de façon passagère pendant quelques jours). Cette immunité est souvent empreinte des particularismes du tissu d'origine (production d'IgA et IgAs dans les muqueuses, actvité des lymphocytes intra-epitheliaux dans la peau..). |
| immunité des muqueuses | = immunité intermédiaire, ressemblant à une immunité locale (peu de répercussion systémique et peu de mémorisation), mais étendue à l'ensemble des zones muqueuses grâce au "homing". Ainsi les lymphocytes produits au cours d'une stimulation digestive peuvent circuler dans toutes les muqueuses, y compris jusqu'à l'appareil génital ou à la mamelle: ce phénomène assure l'extension de la protection immune dans tout le territoire muqueux, et la transmission de l'immunité au jeune (via les Ig produites dans la mamelle et/ou transférées à travers le placenta). La principale caractéristique de l'immunité des muqueuses est la production d'IgA (et leur sécrétion sous forme d'IgAs). |
| plaques de Peyer | = organes lymphoïdes secondaires placés en bordure de la muqueuse digestive. Les cellules M forment un revêtement epithelial particulier en regard de la plaque de Peyer : elles transfèrent les antigènes et les µorganismes de la lumière intestinale vers les follicules lymphoïdes ss-jacents. La réponse à l'Ag se développe alors, le plus souvent avec une orientation Th2 (mais quelquefois Th1 dans certains contextes inflammatoires). Les plaques de Peyer assurent donc la réponse immune vis à vis des antigènes et µorganismes de la lumière intestinale ; toutefois, si les les µorganismes sont pathogènes et traversent la muqueuse digestive, la réponse immune s'effectue alors surtout dans les noeuds lymphatiques médiastinaux. On trouve principalement les plaques de Peyer le long de l'iléum (intestin grêle). (fig11: plaques de Peyer) |
| compartimentation de l'organisme (systémique et muqueuse); privilège immunitaire; organes sequestrés | = organisation de l'organisme en divers compartiments immuns dont les échanges sont régulés (fig12: principe de la compartimentation). |
| Il existe des organes, dits "organes sequestrés", dans lequel il y a peu de cellules immunocompétentes, le drainage lymphatique est absent et dont les barrières sont quasi imperméables aux lymphocytes et aux Ig (méninges et cerveau, oeil, oreilles internes, ovaires et testicules..). Il existe dans ces organes des phénomènes de "privilège immunitaire", qui limitent fortement les réponses inflammatoires et spécifiques. L'immunité locale s'installe seulement lors de forte stimulation et l'immunité générale n'y pénètre presque pas (concentration des Ig dans le LCR ou l'oeil très inférieure à la concentration sérique, sauf lorsque un processus immun s'y déroule). De plus, les mécanismes de rejet de cellules étrangères y sont faibles (d'où la possibilité de greffe de cornée..). De ce fait, ces organes présentent des complications physiopathologiques en cas d'infection in situ ou de rupture de barrière (traumatisme oculaire compliqué par une atteinte auto-immune ..). | |
| Il existe également des mécanismes immunitaires particuliers au niveau de la barrière placentaire qui empêchent l'agression d'un foetus histo-incompatible par l'immunité maternelle (imperméabilité du placenta aux Ig, inhibition de l'activité CTL et NK par des facteurs placentaires..). Les Ig diffusent au travers des vaisseaux et imprègnent les tissus, sauf lorsque ces tissus se trouvent derrière des barrières imperméables (méninges et cerveau, oeil, ovaires et testicules..). Les mécanismes de transcytose organisent un passage contrôlé des Ig à travers les barrières vers ces tissus ou vers l'extérieur de l'organisme (IgG à travers le placenta et la glande mammaire, IgAs à travers les muqueuses). | |
| circulation cellulaire | La plupart des cellules immuno-compétentes sont mobiles au sein de l'organisme, d'autant plus que les cellules sont activés par des facteurs chimiotactiques ou des cytokines (cf tableau 1 du cours immun1-11, fig15: circulation des lymphocytes): - les cellules immuno-compétentes sont produites à partir de cellules souches dans les organes lymphoïdes primaires, puis rejoignent les tissus et les organes lymphoïdes secondaires. La production des lymphocytes T CD4 et CD8 passe par 2 organes lymphoïdes primaires (moelle osseuse puis thymus). - les lymphocytes effectuent des circuits entre le sang, la lymphe et les organes lymphoïdes secondaires, de façon à "patrouiller régulièrement" dans l'ensemble de l'organisme. - les cellules présentatrices d'antigène (cellules dendritiques..) peuvent retourner des tissus jusqu'aux organes lymphoïdes secondaires après activation. - les autres cellules effectuent des trajets à sens unique depuis les sites de production jusqu'aux tissus. Elles possèdent une mobilité accrue après activation (diapédèse des neutrophiles vers un site d'infection..). |
| "homing" | = phénomène de circulation préférentielle des lymphocytes entre des tissus de même nature. Ceci s'explique par l'expression, par les cellules immmuno-compétentes, de facteurs d'adhésion et d'intégrines caractéristiques de tissus, qui favorisent la diapédèse dans les tissus exprimant les ligands correspondants. Le homing contrôle également le passage des lymphocytes à travers les capillaires au niveau des organes lymphoïdes secondaires, en fonction de leur état d'activation (les lymphocytes activés se déplacent plus facilement que les lymphocytes mémoire). |
| biodisponibilité d'un antigène | = efficacité biologique d'un antigène, qui correspond à son utilisation réelle par les cellules immunocompétentes après administration. Il s'agit d'un paramètre très difficile à mesurer hors des modèles expérimentaux. La biodisponibilité est un critère très important pour obtenir des réponses immunes efficaces (mise au point de vaccins). La réponse immune dépend de très nombreux facteurs modifiant la biodisponibilité de l'antigène: - nature de l'antigène (protéique/non protéique, stable/instable, hydrophilie, partciule "phagocytable" ou antigène soluble ..), - dose et durée de la stimulation (en fonction de la stabilité de l'antigène dans l'organisme et de sa clearance) - voie d'administration (capacité d'apport vers un organe lymphoïde via le de drainage lymphatique) |
| exclusion immune | = mécanisme simple de régulation de la réponse immune vis à vis d’Ag fréquemment rencontrés (aliments, flore commensale..) au niveau des plaques de Peyer. Les cellules M modulent la présentation par les cellules dendritiques (d’où une réponse Ac stable vis-à-vis des Ag usuels qui ne sature pas les capacités immunes): - activatrice quand elles captent des Ag libres (surtout si signaux de danger) - inhibitrice quand elles captent des complexes Ag-IgAs! Les IgAs, outre leur rôle protecteur contre les infections des muqueuses, participent à la régulation de l'immunité vis-à-vis des antigènes digestifs fréquemment rencontrés: la production d'IgAs est contrôlée par la concentration déjà présente, puisque les antigènes ne sont plus efficacement amenés au niveau des plaques de Peyer (fig16: exemple de l'exclusion immune contre un reovirus chez des souris normales et déficientes en IgA). |
| Théorie du Danger | la théorie du danger (Polly Matzinger et al) explique comment les réponses immunes non spécifiques et spécifiques agissent en synergie pour déclencher une réponse efficace ou au contraire une tolérance : l'activation des TLR des cellules présentatrices par les signaux de danger (d'origine microbienne ou dus à des lésions cellulaires) provoque une différenciation des CPA, d'où la production de cytokines telles que l'IL12 fortement activatrices des lymphocytes T effecteurs (d'où augmentation de la prolifération et de la différenciation à l'Ag). Cette théorie explique comment des stimulations au cours d'infections ou de lésions tissulaires sont plus efficaces et plus pérennes que des stimulations "innocentes" par des antigènes purifiés (d'où l'intérêt de mimer une réponse naturelle complète par des adjuvants lors des vaccinations). Elle explique aussi comment des cellules étrangères sont rejetées violemment au cours d'une chirurgie (inflammation importante associée à l'acte chirurgicale) et sont tolérées dans un contexte "innocent" (gestation..). Un récapitulatif de cette théorie a été publié par Polly Pazinger dans Science, 2002, vol 296 (fig 17: danger models) |
| Théorie de l'Hygiène | la théorie de l'hygiène explique pourquoi des réponses immunes anormales sont fréquentes chez les individus qui ne sont pas exposés au microbisme et au parasitisme "traditionnel". On trouve bien plus souvent des individus allergiques, immunodéprimés ou présentant des maladies auto-immunes dans les pays où une pression hygièniste forte a fait baisser les infections et le parasistime infantiles, et les individus vivant dans une atmosphère "trop propre" développent facilement des allergies et de l'asthme. La théorie explique cela par des troubles de la régulation immune en l'absence d'un taux suffisant de stimulations "innocentes" par le microbisme normal, avec réduction des lymphocytes Th1 et Treg au profit de lymphocytes Th2. |
schémas et figures |
|
1 2
2 3
3 4
4 5
5 .
6
.
6 7
7 8
8 10
10 11
11 12
12 13
13 14
14  15
15 16
16 17
17
tableaux |
élements d'application et de raisonnement |
| La distinction de sous-populations fonctionnelles Th1-Th2 a été découverte dans le modèle de la leishmaniose murine: - les souris C57Bl6 sont protégées contre l'infection, mais pas les souris Balb/c , qui sont malades. Peu de différences ont été remarquées dans la réponse immune anti-Leishmania de ces souris (mêmes antigènes reconnus, même réponse anticorps..). Les 2 lignées ont montré l'importance de l'immunité cellulaire (transfert de la protection par injection de lymphocytes T entre souris immunes et souris naïves). - le transfert de clones lymphocytaires T spécifiques d'un même antigène a montré des résultats très discordants, variant de 0 à 100% de protection. Il apparait que les clones protecteurs produisent de l'interféron gamma (clones Th1) tandis que les clones non protecteurs n'en produisent pas (production d'IL4 et IL5). La protection ne dépend pas que de la spécificité et de l'intensité de la réponse immune, mais aussi de sa qualité. - la production de profils de cytokines distincts par les clones Th1 et Th2 est un caractère fixé au cours de la différenciation lymphocytaire (elle persiste en culture in vitro). Ces 2 populations s'individualisent à partir de clones Th0 (précurseurs) en fonction des conditions de présentation de l'antigène. Les clones favorisant les mécanismes d'immunité humorale ou cellulaire sont mutuellement exclusifs (sécrétion de cytokines inhibitrices des autres sous-populations). Cette découverte a ensuite été étendue à de très nombreuses autres situations et espèces. |
La distinction de sous-populations fonctionnelles Th1-Th2 a fortement contribué à la compréhension de la physiopathologie: |
| Le transfert d'immunité cellulaire est un phénomène qu'on peut analyser dans les souches de souris syngéniques (les souris possèdent un génome identique à 100%: histocompatibilité totale). Les modèles les plus sophistiqués sont ceux de "reconstitution immune": on greffe des lymphocytes ou des cellules précurseurs à des souris receveuses normales ou qui n'ont aucune immunité (souris "scid"). Il est même possible de greffer à des souris scid des lymphocytes humains, qui confèrent à ces souris une immunité "normale" humaine= souris "scid humanisées". |
| La question se pose maintenant de connaitre les signaux qui modulent la différenciation des lymphocytes vers l'une ou l'autre sous-population Th1/Th2 (influence des cytokines produites par les CPA en réponse aux signaux de danger, facteurs du micro-environnement tissulaire?..). |
| De nombreuses approches thérapeutiques et prophylactiques de l'immunité s'appuient sur ces concepts Th1/Th2: - on peut maintenant identifier dans les modèles d'infections expérimentales quel est le type d'immunité nécessaire et tenter d'orienter la réponse vaccinale vers celui-ci, par exemple en travaillant sur les modalités d'administration d'un vaccin (voie, dose, adjuvants..) - certains troubles de la gestation et plusieurs maladies auto-immunes sont associés à un déséquilibre Th1/Th2. - les essais de désensibilisation allergique tendent à restaurer l'équilibre Th1/Th2 vis-à-vis de l'allergène. L'identification des populations Treg et Th17 a fortement contribué à la compréhension des équilibres inflammation/réponse spécifique/tolérance, et leur rôle est suspecté dans de nombreux phénomènes immunopathologiques. |
| L'anergie est un phénomène rare dans les situations naturelles et difficile à analyser in vivo et in vitro. Toutefois, il a une grande importance médicale, à la fois parce qu'il explique certaines réactions paradoxales d'infections chroniques (absence de réponse immune dans des cas avancés de tuberculose..), et parce qu'il représente une perspective de recherche pour le traitement des problèmes immunopathologiques. |
| Bien que la production d'anticorps anti-idiotypiques soit très faible dans les situations normales, il est possible d'obtenir dans certaines circonstances expérimentales ou pathologiques jusqu'à 2 ou 3 générations d'anticorps anti-idiotypiques successives, formant un réseau de réactions entre anticorps, se régulant les unes les autres. La formation de ce réseau a quelques applications conceptuelles et médicales. Il semble en particulier que des déséquilibres dans la production d'anticorps et d'anticorps anti-idiotypiques soit impliqués dans plusieurs maladies auto-immunes; l'administration de pools d'Ig est même pratiquée en thérapeutique humaine pour la correction de déficit immuns et de maladies auto-immunes. Par ailleurs, le concept d'image interne permet de concevoir une protéine (l'anticorps anti-idiotypique) qui présente des épitopes B similaires à ceux d'un antigène non protéique (au stade de la recherche, il s'agit d'une astuce pour concevoir des antigènes immunogènes à partir d'antigènes qui ne le sont pas!). |
| Les plaques de Peyer ont un rôle important dans la régulation de l'immunité vis-à-vis des antigènes d'origine digestive: - les lésions de la muqueuse amènent directement les antigènes vers les lymphocytes et structures lymphoïdes sous-jacentes (cas d'une infection par un micro-organisme entéropathogène..) en court-circuitant les plaques de Peyer, et éventuellement en provoquant une inflammation locale et des signaux de danger. On obtient une réponse immune classique (IgM et IgG..). - les antigènes protéiques solubles et les micro-organismes non pathogènes sont récupérés dans la lumière digestive par les cellules M et transportés pour être présentés aux lymphocytes des plaques de Peyer. On obtient une réponse locale, principalement à base d' IgA et IgAs. Ce phénomène diminue quand ces antigènes ont donné déjà naissance à une réponse anticorps IgAs (qui empêche la captation par les cellules M = mécanisme "d'exclusion immune"). Cette réponse locale diffuse peu dans l'ensemble de l'organisme, mais assure une première ligne de protection contre des antigènes et des micro-organismes opportunistes fréquemment rencontrés. |
| Seule une faible partie des antigènes protéiques alimentaires donne lieu à une réponse immune, en premier lieu parce qu'ils sont dégradés par les processus de digestion en amont des plaques de Peyer. |
| La durée, l'intensité et la qualité de la réponse immune obtenue au cours des infections et parasitoses varie considérablement d'un agent pathogène à l'autre: - la plupart des infections virales donnent lieu à une réponse immune systémique, à l'exception des virus dont la propagation se fait surtout par voie nerveuse car ils sont peu exposés au système immunitaire (rhabdovirus, herpesvirus..). - la plupart des infections digestives qui n'occasionnent pas de lésions profondes des muqueuses ne donnent pas lieu à une réponse immune systémique mais seulement à une réponse locale (entérobactéries, coccidies, Helicobacter..). |
| Une grande partie de la difficulté de conception des vaccins est de procurer une immunité intense et prolongée (plutôt de nature systémique) aux voies d'entrée de l'agent pathogène (plutôt des portes muqueuses)! |
| Malgré son avantage évident sur le plan pratique, la vaccination par voie orale n'est quasiment pas utilisée car elle nécessite des formulations antigéniques complexes et l'immunité n'est pas forcément d'une qualité et d'une durée suffisante (il faut protéger les antigènes de la dégradation stomacale, faciliter leur transport vers les plaques de Peyer..). Les vaccins commericalisés actuellement qui sont efficaces par voie muqueuse (administration orale, conjonctive ou nasale) sont des préparations qui contiennent des µorganismes vivants. |
références et cours disponibles |
pour en savoir plus :
- "Regulation in mice of protective immunity against Leishmania major" Jacques Louis et al, 1998, Current Opinion in Immunology, 10, p459
- "Human TH1 and TH2 subsets: doubt no more" S. Romagnani, 1991,Immunol. Today 12, 256–257.
- "
The immunoregulatory role of CD1d-restricted natural killer T cells in disease" HJJ van der Vlie, 2004, Clinical Immunology, 112/1, p8-23 (*)
- "Human CD4+CD25+ regulatory T cells" C Baecher-Allan, 2004, Seminars in Immunology, 16/2 (*)
- "Pregnancy: success and failure within the Th1/Th2/Th3 paradigm" Raj Raghupathy, 2001, seminars in Immunology, Vol. 13 pp. 219–227
- "Mechanisms of action of intravenous immunoglobulin in autoimmune and inflammatory diseases" J.Bayry et al, 2003, Transfusion Clinique et Biologique, 10/3, p165-169
page réalisée par le Dr Delphine Grézel, VetAgro Sup, Campus Vétérinaire de Lyon, le 28/05/14 . Merci pour les corrections, commentaires et suggestions (delphine.grezel@vetagro-sup.fr)