 2
2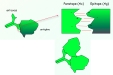 3
3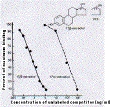 4
4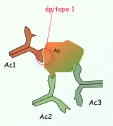 5
5 6
6 7
7 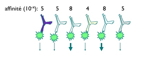
IgG
 IgM
IgM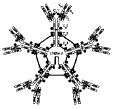 IgAs
IgAs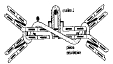 IgE
IgE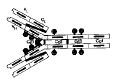 IgD
IgD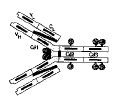
| accueil | immun 1-03 : Réaction antigène-anticorps; structure des immunoglobulines (Ig); classes d'Ig |
<-- cours --> |
objectifs pédagogiques (*) ------------------courte Présentation du cours immun03 YouTube--------------------- |
|
|
- faire le schéma d'un anticorps en indiquant les régions importantes sur le plan fonctionnel (domaines, Fc, Fab, paratope) ; distinguer les notions d'Ig et d'Ac (dynamiques de production : cf immun1-06) ; définir la valence d'un anticorps. | |
définitions générales - messages |
|
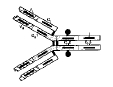
| anticorps (=Ac) | = protéine produite par un lymphocyte B en réponse à une stimulation par un antigène, et capable de se combiner avec cet antigène pour former un complexe antigène-anticorps. Chaque clone lymphocytaire B produit un anticorps dont la séquence et la spécificité est unique (fig1 : réaction Ag-Ac ). Les anticorps sont produits par le lymphocyte sous 2 formes : - des anticorps sécrétés. - une forme membranaire qui est constitutive du récepteur BCR= récepteur à l'antigène du lymphocyte B). |
| spécificité (d'un Ac) | = paramètre indiquant l'aptitude d'un anticorps à discriminer entre 2 antigènes proches (cf définition générale immun1) La complémentarité stérique et électrique d'un anticorps avec l'antigène entraine la formation d'un ensemble +/- important de liaisons faibles (fig2 : complémentarité éléctrique et stérique Ag-Ac). |
| affinité (d'un Ac) | = paramètre indiquant la force de la liaison antigène-anticorps. La réaction antigène-anticorps est une réaction d'équilibre résultant d'un ensemble de liaisons faibles : Ag + Ac <--> Ag-Ac. La fixation n'est pas covalente : le % d'antigène fixé dépend de l'affinité de l'anticorps et des conditions environnementales (température, pH..). L'affinité est très variable d'un anticorps à l'autre (10-4 à 10-9) (fig3 : affinité différente d'un Ac pour 2 antigènes quasi-identiques ). |
| avidité (d'un Ac) | L'avidité est la résultante de l'affinité et de la valence : à affinité identique, un anticorps IgA dimère aura une plus grande avidité pour l'Ag qu'un anticorps IgG. |
| épitope | = partie de l'antigène reconnue spécifiquement par une molécule donnée d'anticorps (taille approximative : quelques acides aminés). synonyme : déterminant antigénique |
| paratope | = partie de l'anticorps qui se combine à l'épitope complémentaire sur l'antigène. Il y a 2 paratopes identiques par anticorps. Le paratope est formé par combinaison des domaines variables des chaines H (Heavy) et L (Light) de l'anticorps. Un antigène peut donc être reconnu par plusieurs anticorps dont les paratopes sont complémentaires de chacun de ses épitopes (fig4 : plusieurs épitopes sur un antigène). |
| immunoglobulines (=Ig) | = Terme décrivant la nature chimique des anticorps (On peut dire que le terme d'Ig identifie la nature, tandis que le terme d'Ac identifie la fonction). Chaque Ac est une Ig qui possède une séquence unique à l’extrémité de domaines «variables», ce qui lui confère sa spécificité. Les Ig se caractérisent par une structure globuleuse contenant des domaines, c'est à dire des zones de repliement de la séquence indépendantes sur le plan structural et fonctionnel (fig5 : structure générale des Ig). La synthèse d'une protéine de type Ig résulte de l'assemblage de plusieurs gènes pour former une chaine comprenant plusieurs domaines (cf système génétique de production des Ig). |
| La structure de base des anticorps (type IgG) est un complexe de 4 chaines protéiques identiques 2 à 2 (2 chaines H =Heavy et 2 chaines L=Light), fixées par des ponts disulfure inter et intra-caténaires. Chaque chaine d'Ig contient des domaines constants et variables. On identifie 2 régions distinctes sur chaque anticorps (en les fractionnant à l’aide d’enzymes..) : - la région Fc ("fragment cristallisable") contient les domaines constants, et assure des fonctions communes à tous les anticorps. - la région Fab ("antigen binding fragment") contient des domaines constants et variables, et fixe l'antigène. |
|
| Variations de la structure des Ig : - Variations idiotypiques (au niveau des domaines variables) : chaque clone lymphocytaire produit un seul idiotype, qui correspond à une spécificité définie déterminée par les domaines variables des chaines H et L. Un individu produit des millions d'idiotypes différents dans sa vie (autant de clones B). - variations isotypiques (au niveau des domaines constants) : chaque clone lymphocytaire peut produire - selon son état de différenciation - plusieurs isotypes, en utilisant des allèles différents qui codent pour les domaines "constants" des chaines H (classes et sous classes d'Ig : IgM, IgG, IgA, IgE, IgD) et L (kappa ou lambda). - variations allotypiques : variations au niveau des jonctions entre domaines. Ces variations s'expliquent par le système génétique de production des Ig (chaines H et L codées par association de plusieurs gènes qui regroupent chacun un grand nombre d'allèles). |
|
| valence (d'un Ac) | = nombre d'antigènes identiques que peut fixer une molécule d'anticorps (2, 4 ou 10 selon les classes d'Ig). La valence intervient dans la capacité des anticorps à former des complexes macro-moléculaires composés de nombreux antigènes et anticorps (formation d'un réseau macromoléculaire). |
| isotype | = variation structurale des Ig affectant les domaines constants des chaînes H et L (séquence génétique, nombre de domaines, nombre de ponts S-S assurant la cohésion de l'Ig, % de glycosylation..) = variations dans la région Fc de l’Ig (fig6 : variations structurales des Ig) : |
| idiotype | = variation structurale des Ig affectant les domaines variables, et donc le paratope (dizaines de milliers de variations possibles). Chaque clone lymphocytaire produit un idiotype différent (fig6 : variations structurales des Ig). remarque : idios= racine grecque d'individu, original, particulier |
| allotype | = variation structurale des Ig affectant les jonctions entre domaines (quelques dizaines de variants possibles). Il s'agit essentiellement de variations intraspécifiques dues au système génétique de production des Ig. Ces variations permettent de distinguer au sein d'une espèce des groupes d'individus présentant les mêmes allotypes. (fig6 : variations structurales des Ig) |
| Maturation de l'affinité | L’affinité de la réponse Ac augmente durant la réponse à l'Ag (dans la grande majorité des cas, la réponse anticorps est polyclonale : elle implique de nombreux clones lymphocytaires B capables de reconnaitre un même Ag par ses différents épitopes) : - les clones les plus affins sont sélectionnées (plus d’activation par l’Ag) (par compétition à la fois entre clones B reconnaissant un même épitope et entre clones B reconnaissant des épitopes différents mais proches) - certains clones lymphocytaires B peuvent subir des mutations dans la séquence produisant l’anticorps : sélection des clones les plus affins La maturation de l’affinité s’effectue ± selon la biodisponibilité de l’Ag : - infulence de la durée/répétition du contact avec l’Ag - influence de la concentration de l’Ag (forte concentration : peu de sélection; faible concentration (mais suffisante) : sélection ++) (fig7 : maturation de l'affinité) |
schémas et figures |
|
1 2
2 3
3 4
4 5
5 6
6 7
7 
IgG IgM
IgM IgAs
IgAs IgE
IgE IgD
IgD
tableaux |
élements d'application et de raisonnement |
| En pratique, on utilise le terme d'immunoglobuline (Ig) pour désigner la nature chimique et le terme d'anticorps (Ac) pour désigner la fonction (on sous-entend la spécificité pour un Ag donné quand on parle d'Ac). Le taux des Ig reste globalement stable, tandis que le taux d'un Ac donné peut varier considérablement. |
| Les anticorps assurent un rôle d'intermédiaire qui sont capables de faire réagir l'organisme contre une multitude de cibles (cf fig 5 cours immun1-04) : - la partie variable (Fab) fixe l'antigène. L'anticorps complexé à l'antigène désigne la cible de la réponse immune. Le très grand nombre d'anticorps différents répond à l'extrême diversité des microbes. - la partie constante (Fc) transmet le signal, activant les mécanismes effecteurs de la réponse immune contre la cible désignée. La combinaison des effets de plusieurs classes d'anticorps permet d'adapter la réponse. |
| Le terme d'antigène n'est pas une notion structurale mais fonctionnelle (des molécules de taille et de structure variées sont des antigènes; des molécules de structure différente peuvent être reconnues par un même anticorps). Un micro-organisme exprime des dizaines d'antigènes différents qui peuvent donner lieu chacun à une réponse immune spécifique indépendante. |
| Les variations isotypiques des Ig permettent d'adapter finement la réponse immune au type d'agression, car chaque classe d'Ig possède une distribution, des propriétés biologiques, et donc des fonctions différentes. La réponse immune évolue dans le temps à la fois en quantité (production d'anticorps adaptée à l'antigène) et en qualité (classe des anticorps produits). |
| Plus généralement, on regroupe au sein d'une "superfamille des Immunoglobulines" l'ensemble des protéines qui sont construites sur le modèle des Ig, avec un ou plusieurs domaines constants ou variables : beaucoup d'autres protéines impliquées dans l'immunité appartiennent à cette superfamille (Ig, BCR et TCR, récepteurs de surface des lymphocytes, cytokines..). L'analyse évolutive de ces protéines permet de comprendre comment l'immunité s'est créée et "complexifiée" depuis les poissons jusqu'aux mammifères. |
| L'évolution de l'affinité au cours de la réponse anticorps a des conséquences importantes : - la réponse anticorps est souvent plus affine durant la réponse secondaire, ce qui accroit son efficacité (capacité neutralisante..) - la dose d'antigène a une forte influence (d'où l'importance de bien fixer la dose d'un vaccin : ni trop peu, ni trop). |
- aborder la diversité biologique des espèces et des individus en donnant des exemples de protéines présentant des variations inter ou intraspécifiques, ou inter-individuelles; quelle en est la signification biologique? quelle en est le fondement moléculaire (notions d'homologie, de mutation, d'allèle; notion d'espèce et de souche microbienne..).
- faire un schéma expliquant comment la réaction entre un antigène comprenant plusieurs épitopes et un mélange d'anticorps reconnaissant ces différents épitopes peut aboutir à la formation de réseaux macro-moléculaires. Etudier l'effet de la valence sur la création de complexes.
- décrire différentes courbes illustrant la réaction antigène-anticorps (comparaison des spécificités et affinités). Etudier l'effet de l'affinité sur le % d'antigène restant libre.
- "jouer" avec les concepts de variations structurales inter et intraspécifiques des Ig (exemple : combien trouve t'on d'isotypes chez le chien? quelles sont les variations des Ig qu'ont en commun un jeune et sa mère?).
références et cours disponibles |
Cours d'immunologie générale sur le serveur de l'ENVL : fonctions des anticorps (immun1-04), techniques d'analyse des anticorps (immun1-05) et production des anticorps (immun1-06)
cours de génétique des Ig
pour en savoir plus :
- affinité : http ://users.rcn.com/jkimball.ma.ultranet/BiologyPages/A/Affinity.html
- "Comparative functional characterization of canine IgG subclasses" Bergeron, L. M., McCandless, E. E., Dunham, S., Dunkle, B., Zhu, Y., Shelly, J., et al. (2014 Veterinary Immunology and Immunopathology, 157(1-2), 31–41. doi:10.1016/j.vetimm.2013.10.018
page réalisée par le Dr Delphine Grézel, VetAgro Sup, Campus Vétérinaire de Lyon, le 23/04/14 . Merci pour les corrections, commentaires et suggestions (delphine.grezel@vetagro-sup.fr)