objectifs pédagogiques (*) |
- lister les principaux mécanismes immuns impliqués dans la destruction des cellules tumorales
- donner des exemples d'application des outils immunologiques au diagnostic et au suivi des processus tumoraux
- donner des exemples de traitement immunologique des tumeurs |
définitions générales - messages |
| immunogénicité d'une tumeur |
Il existe de très nombreux types de tumeurs, et donc l'immunogénicité des tumeurs, c'est à dire leur aptitude à induire une réponse anti-tumorale, est très variable.
Un grand nombre de cellules tumorales sont détruites en permanence par l'immunité normale d'un individu (ce qui explique que les tumeurs apparaissent plus facilement chez des individus présentant des troubles de l'immunité); malheureusement les tumeurs et cancers qui sont constatés sur le plan clinique résultent généralement d'un échec de la réponse immune anti-tumorale naturelle.
|
Cette immunogénicité présente 3 avantages :
- possibilité d’une réponse immune anti-tumorale naturelle (ou induite)
- diagnostic du type tumoral par immunohistochimie, afin de mieux faciliter le choix d’un anti-tumoral adapté et le pronostic (utilisation des marqueurs CD..)
- Suivi du nombre de cellules tumorales (et recherche de métastases) par imagerie nucléaire in vivo avec des anticorps radio-marquées au cours du traitement (ou plus simplement dosage d’antigènes tumoraux circulants dans certains cas comme le cancer du colon ou de la prostate chez l’homme).
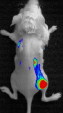
Fig 1: bilan d’extension tumoral in vivo par imagerie avec un anticorps anti-tumoral radiomarqué, montrant l’apparition de métastases
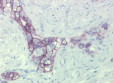
Fig 2: immunohistochimie d’une tumeur ovarienne montrant des cellules d’origine hématopoietique (CD34+) |
Les cellules tumorales peuvent plus ou moins se distinguer des cellules normales d'un tissu, et donc induire un processus immun protecteur:
- selon qu’elles présentent des antigènes tumoraux, issus d’infections par des virus oncogènes, de mutations et/ou d'anomalies de la physiologie cellulaire (modification des marqueurs CD usuellement attendus..). Ce n’est pas le cas de toutes les tumeurs.
- selon que les tumeurs entrainent des processus d'inflammation et/ou des modifications physiologiques (problème de transit intestinal si tumeur digestive, modifications de la vascularisation..).
- selon qu'elles présentent une diminution de l'expression des antigènes du CMH et/ou de facteurs d’adhésion/communication R-TNF, Fas..) et/ou de facteurs anti-oncogènes (p53..) : très souvent les cellules tumorales modifient leurs synthèses protéiques par rapport aux cellules normales en raison de la prolifération-dédifférenciation. |
| immunité anti-tumorale |
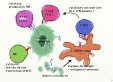
= ensemble des mécanismes susceptibles de détruire des cellules tumorales. (cf tableau 1: principaux mécanismes anti-tumoraux).
La réponse naturelle dépend surtout de l'immunité cellulaire (activités CTL et NK), et dans une moindre mesure des anticorps (un peu d’ADCC). fig3 : principaux mécanismes anti-tumoraux (simplifié !). La coopération cellulaire, basée sur les interactions CD4-CD8 et les cytokines, est indispensable pour une cytolyse efficace.
En médecine humaine, les traitements les plus novateurs s'appuient en synergie sur des traitements "classiques" (chiomiothérapie, radiothérapie..) et sur une stimulation de la réponse immune. Certains immunomodulateurs sont trop toxiques pour être utilisés in vivo: on effectue alors une démarche ex vivo (cf figure). |
| principaux antigènes tumoraux |
oncogènes= forme mutée d'un proto-oncogène cellulaire, ou forme normale mais exprimée en concentration très supérieure à la normale (surexpression). (cf cours de biologie moléculaire et de cancérologie). Les proto-oncogènes correspondent à des facteurs de prolifération-différenciation qui sont exprimés de façon contrôlée dans les cellules normales, mais perdent ce contrôle lors de la tumorisation. Malheureusement, les oncogènes sont très peu immunogènes (il s'agit de protéines du soi, très conservées entre espèces). |
| néo-antigènes= protéines anormales issues de mutations ou d'expression anormale (antigènes propres à un tissu particulier ou exprimés seulement chez l'embryon..)... Les tumeurs sont occasionnées par l'accumulation de mutations et modifications chromosomiques, qui peuvent modifier l'expression des protéines, voire même faire apparaitre de nouvelles séquences protéiques. Malheureusement ces néo-antigènes présentent beaucoup d'homologies avec les antigènes normaux, et sont donc très peu immunogènes. |
| antigènes viraux (tumeurs d'origine virale): antigènes solubles, ou exprimés dans le cytoplasme des cellules infectées (qu'elles soient ou non tumorales). Les principaux virus oncogènes sont les retrovirus (FeLV..), les herpesvirus (leucose aviaire..), les papillomavirus.. |
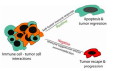
échappement à l'immunité anti-tumorale
|
Il existe souvent un déficit général de l'immunité chez les patients atteints de tumeurs sévères, entrainant des complications (surinfection, aux troubles immuns..). Ce déficit peut résulter soit:
- de
l'effet délétère de la tumeur sur le métabolisme, voire sur l'immunité (tumeurs lymphoïdes..),
- du traitement anti-tumoral (traitement cytotoxique ou anti-mitotique) |
Les tumeurs peuvent résister par différents moyens à la réponse immune (ceci d'autant plus qu'elles se développent plus souvent chez des individus présentant des troubles de l'immunité, tels qu'un déficit immunitaire ou une maladie auto-immune):
- par leur agressivité: les cancers à prolifération très rapide et forte inflammation, ou dont les cellules mutent plusieurs fois au cours du processus submergent les capacités immunes (les métastases sont souvent plus résistantes que la tumeur d'origine).
- au contraire par leur discrétion, correspondant à une très faible antigénicité (absence de néo-antigènes, fibrose périphérique..) et à une très faible immunogénicité des antigènes tumoraux (peu de lymphocytes spécifiques répondeurs): les cellules dendritiques ne s'activent pas.
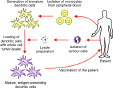
fig : méthodes employées en médecine humaine pour activer les cellules dendritiques ex vivo ou in vitro.
- par leur localisation dans un tissu où il y a peu de circulation lymphocytaire (cerveau, gonades, oeil..) ou dans lequel la réponse immune est naturellement inhibée par les cytokines de l'homéostasie immune (foie, moelle osseuse..).
- par dysfonctionnement de l'immunité: les facteurs produits par la tumeur peuvent inhiber le fonctionnement normal de l'immunité, de même que l'inflammation excessive. Ainsi certains oncogènes et cytokines produites par les cellules tumorales modifient les capacités de prolifération des lymphocytes ou l'adhésion cellulaire (TGFbeta..).. Ce phénomène est particulièrement problématique lorsqu'il s'agit de tumeurs affectant le système immunitaire lui-même, productrices de cytokines inhibitrices de la réponse immune (lymphome, plasmocytome, mastocytome..).
En médecine humaine, en synergie avec les traitements "classiques" (chiomiothérapie, radiothérapie..), on utilise des procédés novateurs pour contrer l’évasion immune, afin de stimuler les lymphocytes ou les cellules dendritiques, ou de rendre plus immunogènes les cellules tumorales... Certains traitements immunomodulateurs sont trop toxiques pour être utilisés in vivo: on effectue alors une démarche ex vivo.
fig4 : méthode employée en médecine humaine pour activer les cellules dendritiques ex vivo et générer ainsi l’immunité anti tumorale (les cellules sont cultivées in vitro en présence de doses de cytokines qui seraient toxiques in vivo) |
| immunotoxine |
=molécule composite produite au laboratoire, associant un élément susceptible de reconnaitre les cellules tumorales (anticorps..) couplé à une toxine (ricine, radio-isotope..). L'immunotoxine a pour but de traiter en délivrant un produit hautement cytotoxique directement au contact des cellules tumorales, le plus spécifiquement possible ( , de façon à limiter les effets néfastes sur les cellules saines. fig: exemples d'immunotoxines La majorité des anticorps utilisés sont des anticorps monoclonaux: cf immun1-14.
Il existe de nombreux types d'immunotoxines, adaptés à différents types de tumeurs (la majorité sont encore au stade de la recherche ou des essais cliniques chez l'homme) (cf tableau 2: outils immunologiques en thérapeutique anti-tumorale). Fig5 : exemples d’outils immunologiques anti-tumoraux |
schémas et figures |
tableau 1: principaux mécanismes anti-tumoraux |
activité anti-tumorale |
principe |
| anticorps |
± à ++ (selon type tumoral)
en présence de complément ou de cellules cytotoxiques |
- on observe rarement des anticorps efficaces au cours des réponses immunes naturelles (faible immunogénicité des antigènes tumoraux). La cytolyse est liée principalement à l'activité ADCC (anticorps + cellules) et à l'activité cytolytique du complément en présence d'anticorps; toutefois, certaines cellules tumorales restent refractaires à l'action cytolytique du complément en exprimant des protéines protectrices membranaires (cf complément: immun1-13). L'activité cytotoxique consomme donc une grande quantité de complément et occasionne une réaction inflammatoire.
- les anticorps issus de l'immunotechnologie ont de bonnes efficacités dans les essais cliniques pratiqués en médecine humaine (mais chaque type tumoral nécessite de fabriquer l'anticorps correspondant= une vingtaine existent maintenant). |
| lymphocytes T CD4 |
+ (complémentaires des autres lymphocytes) |
stimulation de l'activité CTL et NK par l'IL2 et l'IFNgamma (reconnaissance d'antigènes tumoraux présentés par des cellules exprimant le CMH de classe 2). |
| lymphocytes T CD8 |
++ |
activité cytotoxique si les cellules expriment des antigènes tumoraux associés au CMH de classe 1 |
| lymphocytes NK |
++ |
activité cytotoxique si l'expression de CMH de classe 1 diminue |
tableau 2: outils immunologiques dans la lutte anti-tumorale |
utilisation thérapeutique |
utilisation diagnostique |
| anticorps (le plus souvent anticorps monoclonaux) |
anti-oncogènes |
administration in vivo (perfusion iv) pour provoquer la cytolyse des cellules tumorales par des anticorps reconnaissant un antigène tumoral exprimé à la membrane cellulaire, par un mécanisme d'ADCC ou de cytolyse complément-dépendante.
(exemple: "Epratuzumab, a Humanized Anti-CD22 Antibody, in Aggressive Non-Hodgkin’s Lymphoma" Leonard et al, Clinical Cancer Res. 2004;10/16:5327-34) |
- dosage des oncogènes circulants (ex: suivi après traitement de certaines tumeurs du colon..);
-
identification du type tumoral pour évaluer la sensibilité thérapeutique et le pronostic (ex: cancer du sein/erv2) |
| anticorps anti-marqueurs membranaires (anti-CD..) |
- in vitro (immunohistologie sur biopsie): identification du type tumoral pour évaluer la sensibilité thérapeutique et le pronostic
- in vivo (imagerie en utilisant des anticorps radio-marqués): topographie de la tumeur, recherche de métastases.. |
| immunotoxines |
anticorps-toxine |
cytolyse par effet ciblé sur un antigène exprimé à la membrane cellulaire:
- antigène tumoral (effet limité à la tumeur)
- antigène caractéristique d'un type cellulaire (effet sur la tumeur mais aussi sur des tissus sains) |
|
| cytokine-toxine |
cytolyse par effet ciblé sur les cellules exprimant le récepteur à cette cytokine (effet sur la tumeur mais aussi sur des tissus sains) |
|
| cytokines |
utilisation de cytokines activatrices de l'activité CTL et NK (IL2..) |
traitement in vivo ou ex vivo pour augmenter l'activité CTL:
- in vivo (interferon alpha dans l'hépatite B)
- ex vivo (IL2..): immunostimulation en culture des lymphocytes T du patient en présence de cellules tumorales, de cellules dendritiques et d'IL2. |
|
élements d'application et de raisonnement |
La cancérologie est beaucoup plus développée en médecine humaine qu'en médecine vétérinaire. Toutefois, il est utile que les informations circulent entre les médecins et les vétérinaires dans ce domaine, en particulier pour contribuer aux progrès des connaissances fondamentales (cancérologie comparée) et de la prévention (facteurs de risque communs aux hommes et animaux..). |
La création de nouvelles thérapeutiques antitumorales repose sur une recherche fondamentale de très haut niveau:
- connaissance des mécanismes moléculaires impliqués dans la croissance tumorale (prolifération, vascularisation..) pour identifier des cibles thérapeutiques
- identification des marqueurs membranaires pour cibler les cellules tumorales (diagnostic par imagerie, anticorps anti-tumoraux..). Le diagnostic immunohistochimique (et maintenant génétique) du type tumoral est un élément essentiel pour mettre en place un traitement et un suivi efficaces. |
La recherche en cancérologie utilise de nombreux modèles animaux:
- animaux domestiques présentant des cancers similaires à ceux de l'homme (cancérologie comparée)
- rongeurs de laboratoire présentant des mutations occasionnant des cancers ..
- rongeurs de laboratoire hébergeant des greffes de tumeurs humaines ou animales (ces rongeurs sont immunodéficients: ils ne rejettent pas la tumeur spontanément. On peut essayer alors de provoquer la destruction tumorale par des nouveaux médicaments anti-tumoraux ou en transférant des lymphocytes anti-tumoraux provenant d'animaux immunisés pour évaluer leur efficacité). |