 1b
1b 2
2  3
3  4
4 5
5 6
6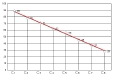
| accueil | immun2-11: Principes d'analyse de l'immunité- interprétation des tests; immunité comparée des vertébrés |
<-- cours --> |
objectifs pédagogiques (*) |
|
|
- comparer les principes de l'étude globale de l'immunité et de l'étude de l'immunité spécifique. | |
définitions générales - messages |
|
| diagnostic | = recherche de la cause de symptômes. Le diagnostic clinique (symptômes + lésions +commémoratifs..) peut être complété par de nombreux examens complémentaires (imagerie, biochimie, microbiologie-parasitologie, immunologie, histologie..). (cf tableau1: différentes approches du diagnostic immunologique). Au sens large, le diagnostic englobe aussi le dépistage (le dépistage étant la recherche d'une contamination en l'absence de syptômes: cf immun2-12). |
| Il existe de très nombreuses techniques immunologiques appliquées au diagnostic: - des techniques visant à vérifier le bon fonctionnement du système immunitaire ou à donner des indications pathologiques générales (examen des ganglions, numération-formule leucocytaire, dosage des Ig totales..) - les méthodes de diagnostic/dépistage des infections et parasitoses - des techniques biochimiques ou histologiques qui utilisent des anticorps pour rechercher/doser la présence d'une molécule donnée dans un prélèvement (reproduction: dosage de progesterone, cancérologie: identification du type tumoral..) |
|
| Le choix d’un test immunologique plutôt qu’un test microbiologique ou génétique (PCR..) doit se décider au cas par cas, selon la dynamique et la fiabilité de la réponse immune infectieuse/parasitaire. fig1a : cinétique retardée des anticorps lors d’une infection aigue (hépatite A) ou au contraire fig1b: précoce lors d’une infection chronique (FIV : paramètres sanguins au cours des mois post contamination) fig2 : fiabilité d’un test basé sur les anticorps (risque d’erreur par défaut d’anticorps, par réaction croisée..) |
|
| Schématiquement, on peut distinguer 2 méthodes de techniques de diagnostic des infections et parasitoses (cf immun2-12): - méthodes directes: mise en évidence du µorganisme/parasite ou de constituants caractéristiques (ADN, antigènes..). (fig3: exemples de techniques de diagnostic direct, fig4: exemples de techniques immunologiques appliquées à l'identification microbienne en culture, - méthodes indirectes: mise en évidence d'une réponse caractéristique à l'infection/parasitose (réponse anticorps..) fig 5: exemples de techniques de diagnostic indirect) |
|
| titre | = inverse de la dernière dilution ayant donné un résultat positif dans un test (par dilution sérielle d'un échantillon). Le titre fournit une mesure semi-quantitative. (fig6: exemple de détermination du titre dans la technique de fixation du complément par dilutions successives de l'échantillon) |
| extrapolation / gamme | = méthode de mesure quantitative de la valeur de l'échantillon testé en fonction de son résultat, par extrapolation à partir de résultats obtenus dans le même système technique avec des echantillons de valeur connue (gamme). (fig7: exemple d'extrapolation graphique d'une concentration à partir d'un test ELISA). |
| immunologie comparée | = étude des particularités spécifiques de l'immunité et de l'évolution phylogénétique du système immunitaire (cf tableau4: principales caractéristiques de l'immunité des vertébrés) . Ces études sont importantes à plusieurs titres: - pour accroitre les connaissances fondamentales, en particulier en comparant des "options" prises par différentes espèces (particularités des lymphocytes des ruminants et des porcins, particularités du drainage lymphatique des porcins..) - pour adapter les méthodes de diagnostic et les vaccins en médecine vétérinaire (production de réactifs adaptés aux espèces, particularités de la vaccination des oiseaux et poissons..). |
schémas et figures |
|
tableaux |
tableau 1: différentes approches diagnostiques en immunologie |
évaluation du fonctionnement immun global |
évaluation de la réponse immune spécifique |
|
diagnostic indirect des infections |
diagnostic direct |
||
| principe | analyser le fonctionnement normal ou rechercher un dysfonctionnement de l'immunité (déficit, tumeur, allergie, maladie auto-immune..) |
recherche d'une réponse immune spécifique |
recherche d'antigènes |
| exemples | - dosage d'Ig (sérum, colostrum..) - recherche d'anomalies des Ig (electrophorèse es protéines plasmatiques..) - numération-formule sanguine (nombre et aspect des leucocytes) - palpation/radiographie des ganglions - étude des composantes non spécifiques (fièvre/inflammation, complément (dosage, électrophorèse des protéines plasmatiques..) - recherche de lésions auto-immunes (dépots d'anticorps: immunohistochimie..) |
- sérologie des maladies infectieuses (=recherche des anticorps sériques) - exposition contrôlée in vivo à un antigène (IDR tuberculinique, tests allergèniques..) |
- détection d'antigènes microbiens ou parasitaires dans un prélèvement (sérum, fécès..) - détection d'antigènes microbiens ou parasitaires par immunofluorescence sur une coupe tissulaire - détection d'antigènes tumoraux solubles ou cellulaires; identification d'un phénotype tumoral (expression des CD membranaires) |
tableau 3: erreurs et critères de fiabilité du test |
résultat du test: négatif | résultat du test: positif | causes d'erreurs fréquentes pour un test sérologique: (fig5: faux positifs et faux négatifs déterminés en fonction du seuil de positivité d'une technique) | |
| état réel de l'animal (preuve clinique ou technique de référence) | indemne | VN | FP (erreur par excès) | présence d'anticorps interférents (immunité maternelle, vaccination..), test peu spécifique (réaction croisée avec d'autres µorganismes) |
| infecté | FN (erreur par défaut) | VP | test trop précoce (incubation), test peu sensible.. | |
2 paramètres de la qualité d'un test: sensibilité: détecter le maximum d'individus parmi les malades =VP /(FN+VP) et spécificité: détecter le minimum d'individus indemnes =VN /(FP +VN) |
||||
élements d'application et de raisonnement |
| Les causes d'erreur sont nombreuses lorsqu'on utilise des tests immunologiques. Les méthodes directes ont l'intérêt d'apporter une certitude sur l'existence d'une infection en cours quand ils sont positifs (tandis que la présence d'anticorps peut durer après l'élimination de l'infection). (tableau3:erreurs) Par exemple les causes d'erreur d'un test sérologique indirect sont: - test non adapté (utilisation hétérospécifique..), faible spécificité ou faible sensibilité - test de mauvaise qualité ou non interprétable (erreur de réalisation, test périmé ou mal conservé..) - erreurs par défaut liés à une faible réponse immune de l'animal (incubation..)= "faux-négatifs" ( fig1: exemple d'évolution de la réponse anticorps au cours d'une infection aigüe) - erreurs par excès liés à des interférences avec des anticorps provenant d'une autre cause que l'infection (réactions croisées, persistance de l'immunité maternelle chez un jeune < 3 mois, anticorps issus d'une vaccination..) ="faux-positifs" |
| La quantification d'un test n'est pas toujours nécessaire (tableau2: quantification). Toutefois la quantification permet l'analyse de l'évolution de la réponse anticorps dans le temps (comparaison des taux à 2-3 semaines d'intervalle), ou la comparaison à un seuil de positivité, et peut être utile pour décider dans les cas douteux (fig5: principes de la quantification d'un test et de l'établissement de seuils pour limiter les risques d'erreur). |
| L'immunologie comparée est importante pour les vétérinaires: - elle permet d'interpréter de façon juste les similitudes et les différences du fonctionnement normal ou pathologique de l'immunité selon l'espèce à laquelle on a affaire, en limitant les erreurs d'extrapolation à partir données générales connues chez l'homme ou la souris. - elle permet de mettre au point des outils thérapeutiques adaptés (vaccins efficaces chez les oiseaux ou les poissons, réactifs pour l'analyse de l'immunité des animaux sauvages, cytokines à utilisation vétérinaire...). - elle apporte des informations sur la biodiversité et l'évolution des espèces. |
- la recherche de leishmanies chez le chien, par immunofluorescence sur un frottis de moelle osseuse est elle une technique directe ou indirecte?
- faire un schéma représentant les différents temps de l'infection, de la maladie et de la réponse anticorps
- étudier sur quelques exemples les avantages et inconvénients des techniques de diagnostic direct et indirect en immunologie? est ce que les techniques directes sont plus rapides à réaliser que les techniques indirectes? idem..des différentes techniques tertiaires.
- imaginer le principe d'un test semi-quantitatif par titration en inhibition de l'hémagglutination (diagnostic de la grippe)
références et cours disponibles |
pour en savoir plus: cf Travaux Pratiques: TP imm
page réalisée par le Dr Delphine Grézel, VetAgro Sup, Campus Vétérinaire de Lyon, le 9/12/09 . Merci pour les corrections, commentaires et suggestions ( delphine.grezel@vetagro-sup.fr)