 2
2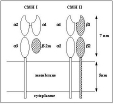 2b
2b 3
3 4
4  5
5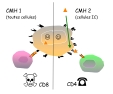 6a
6a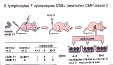 6b
6b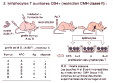 7
7 8
8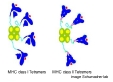 9
9
| accueil | immun 1-10: Complexe majeur d'histocompatibilité (CMH); polymorphisme de l'immunité |
<-- cours --> |
objectifs pédagogiques (*) |
|
|
- décrire les principaux éléments du CMH, leur polymorphisme et leur transmission (citer des conséquences en médecine vétérinaire et productions animales) | |
définitions générales - messages |
|
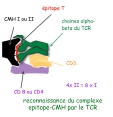
| CMH (Complexe Majeur d'Histocompatibilité) | = groupe de gènes impliqué historiquement dans les phénomènes de rejet de greffes, car ils codent pour des protéines membranaires qui présentent un fort polymorphisme individuel (définition historique= « antigènes leucocytaires », 1940), d'où le fait qu'ils sont des antigènes. Le rôle principal des antigènes du CMH de classe 1 et 2 consiste à assurer la « présentation des épitopes T » aux lymphocytes T. Les antigènes du CMH présentent une poche à peptide capable d’établir des liaisons faibles avec les épitopes T issus du clivage protéique des antigènes (épitopes séquentiels) : il se forme un complexe {CMH-épitope T} qui est reconnu par le TCR. (fig 1: schéma de la reconnaissance conjointe epitopeT-CMH par le TCR du lymphocyte T et fig2: structure des antigènes du CMH1 et CMH2): |
Le CMH présente un polymorphisme très important à la fois : |
|
| La poche à peptide possède une structure différente selon la séquence de chaque moélcule du CMH : elle est donc capable de fixer mieux certains peptides que d'autres car ils établissent plus de liasons : on parle de gamme peptidique pour identifier l'ensemble des épitopes qu'une molécule du CMH est capable de présenter. | |
| haplotype | = ensemble de gènes contigus transmis en un bloc. C'est le cas des gènes du CMH, qui sont étroitement imbriqués sur une région chromosomique courte: un haplotype du CMH comprend l'ensemble des gènes codant pour les 3 classes ( fig3: organisation générale des gènes du CMH humain et murin). Chaque individu exprime les protéines du CMH correspondant à ses 2 haplotypes (co-dominance), celui d'origine maternelle et celui d'origine paternelle (transmission mendelienne des haplotypes du CMH). Des individus d'une même fratrie ont 25% de chances d'avoir le même CMH (donc histocompatibles), alors que la probabilité que 2 individus non apparentés aient le même CMH est < 1/million (cf cours génétique et cours immun2-14). De façon simplifiée, on peut dire que la quasi-totalité des cellules expriment une dizaine de CMH-I (dont chez l'homme 2 HLA-A, 2 HLA-B et 2 HLA-C provenant de la coexpression de l'allèle paternel et de l'allèle maternel, ce qui donne un code individuel distinctif) et que les cellules présentatrices d'antigènes expriment une centaine de CMH-2 (dimères formés à partir des allèles exprimés). |
| greffe (cf immun 3-18) | = prélèvement d'un tissu ou d'un organe chez un donneur, pour l'implanter chez un receveur, soit sans restaurer la position exacte (par exemple: la peau, la cornée, la moelle osseuse...), soit en rétablissant chirurgicalement la continuité vasculaire et dans ce cas on parle de transplantation (rein, coeur..). La greffe n'est acceptée que lorsque les tissus sont totalement histocompatibles (même espèce, même CMH, même groupe sanguin..); dans le cas contraire des mécanismes de rejet aboutissent plus ou moins vite à la destruction du greffon/transplant (d'où la nécessité de réaliser un traitement anti-rejet continu). |
| histocompatibilité (cf immun 3-18) | = aptitude d'une cellule, d'un tissu ou d'un organe à être greffé/transplanté sans rejet, grâce à la similitude entre donneur et receveur des antigènes qui présentent des variations intraspécifiques : - le CMH (antigènes leucocytaires) est à l'origine des réactions de rejet classiques. On distingue des antigènes du CMH "majeurs" (expression par tous les tissus, rejet brutal et rapide) et des antigènes du CMH "mineurs" (expression limitée à certains tissus, rejet chronique). - d'autres systèmes polymorphes peuvent également contribuer au rejet de certains tissus : groupes sanguins, allotypes, antigènes différents selon le sexe.. |
| typage du CMH | Il peut être nécessaire de déterminer quels sont les antigènes du CMH d'un individu (pour réaliser une greffe). Il existe plusieurs méthodes en médecine humaine ou en recherche, qui apportent une précision différente : - sérologie (historique): utilisation d'anticorps de référence capables de distinguer les principaux supertypes des antigènes de classe 1 et 2 (on met les cellules à typer en présence d'anticorps et de complément: mesure de la cytotoxicité). - biologique: réaction lymphocytaire mixte - génétique: utilisation de sondes génétiques capables de distinguer les allèles des gènes du CMH de classe 1 et 2 |
| La recherche en immunologie utilise depuis peu des outils très puissants: la technique des "tétramères" permet d'analyser la réponse spécifique lymphocytaire T à l'échelle clonale, dans le contexte de présentation d’un antigène du CMH purifié (chez la souris, l'homme et le macaque) (fig8: schéma général de tétramères CMH1 et CMH2, fig9: utilisation des tétramères en recherche). | |
| réaction lymphocytaire mixte (RLM) | = technique employée pour vérifier la compatibilité entre un donneur et un receveur (ou pour identifier le type CMH). On met en présence un nombre défini de leucocytes provenant du donneur (ou de cellules de référence) avec un nombre défini de leucocytes provenant du receveur pendant 2-3 jours. En cas d'histocompatibilité, il n'y a pas de modification du nombre des leucocytes (absence de stimulation). En cas d'histoincompatibilité, on observe une prolifération qui peut se mesurer en comptant le nombre final de cellules (par exemple en comptant l'incorporation de thymidine tritiée, ou d'un colorant métabolisé par les cellules). (fig4: principe du test RLM pour l'identification du CMH ) |
| reconnaissance conjointe, complémentarité des voies de présentation et restriction syngénique | Le lymphocyte T effectue une reconnaissance conjointe, à la fois de l'épitope T et du CMH (fig 1: schéma de la reconnaissance conjointe epitopeT-CMH par le TCR du lymphocyte T). Chaque molécule du CMH de classe 1 ou 2 a la capacité de fixer des petites séquences protéiques dans une "poche à peptide": ces séquences issues du clivage des antigènes forment les épitopes T reconnus par les lymphocytes T. Le mécanisme qui aboutit au complexe CMH-épitope T est l'apprêtement antigénique (cf cours immun1-15) Les mécanismes impliquant le CMH de classe 1 et 2 sont complémentaires (figure 5: reconnaissance antigenique par les lymphocytes T CD4 et CD8): - la chaine CD4 renforce la liaison TCR/CMH2 et permet donc une reconnaissance optimale des antigènes récupérés dans le milieu extra-cellulaire par des cellules phagocytaires.. - la chaine CD8 renforce la liaison TCR/CMH1 et permet donc une reconnaissance optimale des antigènes intracellulaires présents dans les cellules qui présentent une anomalie (infection..).. |
| La restriction syngénique rend compte de l'importance du complexe CMH-épitope dans la reconnaissance spécifique (le lymphocyte T ne reconnait pas seulement l'épitope T) : in vitro, on observe que la réponse du lymphocyte T à l'antigène est optimale lorsque la cellule présentatrice d'antigène provient d'un donneur de même CMH que le lymphocyte T, tandis qu'elle diminue si on utilise des cellules présentatrices exprimant un CMH différent (fig6a: expérience princeps de Zinkernagel et Doherty 1974, Prix Nobel 1996/classe 1 - et fig6b: idem classe 2 , fig7: exemple d'analyse de la restriction syngénique) | |
| polymorphisme de l'immunité | L'immunité présente des variations considérables inter et intraspécifiques. - les variations interspécifiques dépendent de l'évolution des espèces (complexité croissante des poissons aux mammifères..) - les variations intraspécifiques des 3 classes assurent une hétérogeneité de la population face à un agent pathogène : on distingue pour chaque infection des individus plus résistants que les autres (une variation leur ayant conféré un avantage); au contraire, la consanguinité est souvent la source d'une plus grande fragilité (on connait chez les souris congéniques des lignées 100% résistantes ou 100% sensibles à un virus donné). - les variations intra et interspécifiques assurent le rejet des greffes. Ce qui est un inconvénient pour la médecine est un phénomène naturel et primitif pour assurer l'intégrité d'un organisme animal! |
schémas et figures |
|
tableaux |
tableau 1: organisation générale du CMH (exemple du système HLA de l'homme) ne pas apprendre! cf IMGT |
classe 1 |
classe 2 |
classe 3 |
|||||||||||
| génome | chromosome 6 |
|||||||||||||
| 7 régions génétiques | 8 régions génétiques | Ensemble d'une vingtaine de gènes codant pour des protéines de l'immunité: TNF, facteurs du complément, enzymes lymphocytaires.. Il existe dans la population un polymorphisme au niveau de ces gènes (d'où une variation individuelle des capacités immunes). |
||||||||||||
| structure protéique | 1 chaine (stabilisée par la ß2 microglobuline) | 2 chaines (possibilité de réaliser de très nombreux dimères différents par combinaisons entre les chaines maternelles ou paternelles) | ||||||||||||
| polymorphisme du CMH | Le polymorphisme génétique est considérable et la fréquence des allèles très différente d'une population à l'autre (fig2b: exemple de polymorphisme HLA-A et HLA-B) . Cependant, la plupart des allèles codent pour des protéines qui ont une séquence et une configuration 3D proche ("supertypes"). Par exemple, il y a plusieurs dizaines d'allèles d'HLA-DR mais ils correspondent seulement à une douzaine de supertypes distinguables par sérologie.
|
|||||||||||||
| Il y a plusieurs milliers de combinaisons CMH possibles. Toutefois, les antigènes du CMH sont contigus et transmis sous forme d'haplotypes: il existe donc de forts déséquilibres de laison dans la transmission de chaque allèle (d'où une fréquence ≠ des allèles selon les ethnies). 2 individus non apparentés ont moins d'une chance sur 1 million d'être histocompatibles; des frères et soeurs ont une chance sur 4 d'avoir le même CMH. cf cours de génétique et immun2-14. | ||||||||||||||
| expression | presque toutes les cellules nuclées (sauf les cellules germinales et les neurones du SNC..) certaines cellules n'expriment pas les formes polymorphes mais seulement les antigènes HLA-E à I (trophoblaste, cellules immatures, foetales...): cela protège le fœtus contre l’immunité maternelle |
lymphocytes, monocytes-macrophages, cellules dendritiques (et quelques autres types cellulaires) | ||||||||||||
| chaque type cellulaire exprime entre 2 et 5 antigènes de classe 1: pour chaque antigène, la cellule exprime les 2 versions (origine paternelle et maternelle). | chaque cellule exprime plusieurs dizaines d'antigènes de classe 2 différents (formés par combinaison entre les différentes chaines d'origine paternelle et maternelle) | |||||||||||||
| taux d'expression | constant (plusieurs milliers de molécules/cellule) | constant ou inductible selon les types cellulaires (certaines maladies auto-immunes sont liées à une expression anormalement élevée des antigènes du CMH2 sur les cellules) | ||||||||||||
| rôles | reconnaissance des cellules du soi par les NK (contrôle de l'intégrité de l'organisme): les cellules NK, grâce à leurs récepteurs KIR, détruisent les cellules anormales qui ne présentent pas un CMH conforme par cytolyse ou par induction d'apoptose (cellules étrangères ou cellules présentant une diminution de l'expression du CMH, par exemple en cas de tumorisation ou d'infection intracellulaire). (cf fig 4 immun1-09) | |||||||||||||
| présentation des antigènes (épitopes T) aux lymphocytes T CD8 (figure 5: reconnaissance antigenique par les lymphocytes T CD4 et CD8) | présentation des antigènes (épitopes T) aux lymphocytes T CD4 (figure 5: reconnaissance antigenique par les lymphocytes T CD4 et CD8) | |||||||||||||
élements d'application et de raisonnement |
| On parle d'antigène du CMH pour désigner le fait que ces protéines sont reconnues comme des antigènes lors de greffes, et qu'elles ont été identifiées grâce à des anticorps de référence (Jean Dausset, Prix Nobel 1958). Cela complique un peu la compréhension (d'où la tentation d'utiliser le terme de "molécule du CMH" au lieu "d'antigène du CMH"!). Les techniques actuelles d'identification du CMH sont à la fois immunologiques (anticorps, RLM) et génétiques (identification allèlique à l'aide de sondes de référence et séquençage). |
| Des lignées de souris congéniques pour le CMH ont été obtenues dans les années 1950-1970 par croisements consanguins: les souris d'une lignée congénique possèdent les mêmes allèles pour tous les gènes du CMH. On a défini ainsi une vingtaine d'haplotypes différents (identifiées H2a à H2z). L 'apport des souris congéniques CMH et des souris syngéniques (totalité du génome identique) à la recherche médicale est considérable: - les souris qui possèdent le même halotype CMH acceptent sans rejet des greffes de tissus et des transfert de lymphocytes (="histocompatibles"), ce qui permet de nombreuses études par transfert de tissus (immuns ou non immuns) d'une souris à l'autre. - il est possible de comparer les réactions immunes obtenues dans des lignées qui possèdent des haplotypes différents (étude de la résistance génétique aux maladies et des capacités de présentation des antigènes..). Des études plus sophistiquées utilisent des souris congéniques pour une partie du CMH seulement (classe 1 identique mais classe 2 polymorphe..). |
| L'analyse du CMH a de nombreuses applications en médecine humaine et vétérinaire en raison de son polymorphisme extrême (filiation et recherche de paternité, génétique des populations, génétique de résistance/sensibilité aux maladies..). Certains allèles du CMH sont associés avec une plus grande résistance aux infections, ou au contraire avec un plus grand risque de développer une maladie auto-immune ou une allergie. |
| Les 2 classes d'antigènes du CMH ont des rôles biologiques complémentaires (figure 5: reconnaissance antigenique par les lymphocytes T CD4 et CD8): - quasi toutes les cellules sont capables de présenter un épitope via le CMH de classe 1. Les complexes epitope-CMH1 sont reconnus par des lymphocytes T CD8 qui ont des capacités cytotoxiques, et peuvent donc détruire des cellules présentant une anomalie. - les cellules immunocompétentes sont capables de présenter un épitope via le CMH de classe 1, mais aussi via le CMH de classe 2. Les complexes epitope-CMH2 sont reconnus par des lymphocytes T CD4 qui ont des capacités régulatrices de la réponse immune, dont profitent les cellules présentatrices (cf cours imm2-12 sur la présentation des antigènes). |
| La recherche en immunologie utilise depuis peu des outils très puissants: la technique des "tétramères" permet d'analyser la réponse spécifique lymphocytaire T à l'échelle clonale (chez la souris, l'homme et le macaque) (fig8: schéma général de tétramères CMH1 et CMH2, fig9: utilisation des tétramères en recherche). Les tétramères sont des complexes produits au laboratoire, associant un fluorochrome (détectable par cytométrie de flux ou immunohistochimie), des chaines protéiques d'un CMH donné (chaines exprimées in vitro à partir des principaux allèles connus du CMH), et un épitope T défini (produit in vitro par synthèse peptidique, déduit de la séquence protéique de l'antigène étudié). Il est ainsi possible de détecter, et même de purifier, les clones lymphocytaires T qui reconnaissent cet épitope en association avec un CMH défini. Cette approche est par exemple utilisée pour identifier les antigènes protecteurs au cours de l'infection par HIV (identification des épitopes impliqués dans la réponse CTL). Elle permet de s'assurer que l'antigène est reconnu efficacement par des individus possédant différents allèles du CMH. |
| On trouve des protéines du CMH dans différentes sécrétions (urine, sueur..): il a été démontré dans plusieurs approches qu'il est possible de ce fait de distinguer des individus en fonction du polymorphisme du CMH (mais on ne sait pas encore quels sont les mécanismes d'olfaction capables de distinguer les protéines du CMH). Cette propriété a des conséquences biologiques considérables, sur lesquelles la recherche se penche activement: - les femelles reconnaissent l'odeur de leur progéniture, et recherchent préférentiellement à s'occuper de souriceaux exprimant un haplotype du CMH identique au leur (études chez la souris) - les femelles reconnaissent l'odeur de leur partenaire sexuel, et recherchent préférentiellement un partenaire sexuel d'un haplotype différent (études chez la souris). - les chiens sont capables de suivre la trace d'un individu sans confondre avec les pistes d'autres individus (chiens policiers: capables de distinguer des hommes!..). |
- interpréter quelques résultats expérimentaux d'activité lymphocytaire dans des lignées murines.
- interpréter quelques résultats expérimentaux utilisant la technique des tétramères
- quelles sont les mécanismes de rejet possibles d'une allogreffe: d'hématies, de rein, de moelle osseuse... Comment expliquer la réaction de "greffon contre hôte"? Dans quel cas peut-elle se produire?
- quel est l'intérêt en recherche des animaux histocompatibles ?
références et cours disponibles |
pour en savoir plus : à l'ENVL: rejet des greffes (immun2-14 -à venir)
Centre d'Immunogénétique (IMGT): http://imgt.cines.fr/textes/IMGTrepertoireMHC/
Principe de la restriction syngénique: http://nobelprize.org/medicine/laureates/1996/illpres/experiment.html; Doherty PC, Zinkernagel RM. A biological role for the major histocompatibility antigens. Lancet, 1406-1409, 1975.
les souris en immunologie (haplotypes H2 des principales lignées..): http://www2.vet-lyon.fr/ens/expa/acc_immuno.htm
immunogénétique de la transplantation: http://www.medicalistes.org/gvhd/docs/articles_en_francais/immunogenetique.html et http://anne.decoster.free.fr/immuno/soigs/soigs.htm
FAQ sur l'utilisation des tétramères: http://www.immunomicsonline.com/faqs.asp
"Genetic resistance to bacterial diseases of animals" L.G. Adams & J.W. Templeton, Rev.sci.tech.Off.int.Epiz.,1998, 17(1), 200-219
"Genetic resistance to Salmonella infection in domestic animals" Wigley, P., Research in Veterinary Science, 2004, 76(3), 165-169
"The sustainability, feasibility and desirability of breeding livestock for disease resistance" MJ STear et al, Research in Veterinary Science, 2001, 71(1) 1-7
page réalisée par le Dr Delphine Grézel, VetAgro Sup, Campus Vétérinaire de Lyon, le 3/02/12 . Merci pour les corrections, commentaires et suggestions ( delphine.grezel@vetagro-sup.fr)