| accueil | Immun2-02: Objectifs de la vaccination; Types de vaccins - composition et considérations pratiques |
<-- cours --> |
objectifs pédagogiques (*) |
|
|
- décrire l'objectif et les modalités d'une vaccination | |
définitions générales - messages |
|
| objectifs de la vaccination | La vaccination a pour objectif de prévenir spécifiquement contre une maladie infectieuse (ou parasitaire) en créant une immunité protectrice durable. Il existe plus d'une centaine de vaccins contre des virus et des bactéries (mais très peu contre les parasites). Cet objectif global se décompose en plusieurs objectifs, qui sont plus ou moins implémentés dans chaque vaccin selon la physiopathologie de l'infection ciblée: - bloquer toute possibilité d'infection de l'animal immunisé (destruction rapide des µorganismes au site d'entrée, avant la diffusion et la multiplication dans l'organisme). Cet objectif n'est pas atteint avec tous les vaccins. - réduire ou supprimer l'expression clinique, en limitant la multiplication du µorganisme ou sa virulence (l'infection reste possible après immunisation, mais elle est contrôlée). - réduire la transmission du µorganisme à partir d'un individu immunisé (l'infection reste possible mais contrôlée). |
| souche vaccinale et souche sauvage (cf cours de microbiologie) | Le fabricant du vaccin est amené à produire au laboratoire des µorganismes sous une forme pure, appelée souche vaccinale, caractérisée (espèce microbienne, lieu et date d'isolement, caractéristiques antigéniques et/ou génétiques..) (cf types de vaccins: immun3-06). La souche vaccinale appartient le plus souvent à l'espèce microbienne responsable de la maladie, mais peut présenter une virulence diminuée: Une souche vaccinale atténuée a perdu son pouvoir pathogène et peut être administrée sans danger (cf atténuation immun3-06). |
| Une souche sauvage est une souche de l'agent pathogène collectée sur le terrain, et pourvue des caractéristiques biologiques classiques (virulence..). Une souche vaccinale présente souvent des modifications qui diminuent (voire suppriment) sa virulence (absence d'enzymes impliquées dans la pathogénicité..). | |
| modalités de la vaccination | La vaccination est un acte médical qui doit faire l'objet d'une analyse rigoureuse: - indications et contre-indications de la vaccination (nécessité d'une analyse du contexte, et d'un examen clinique des animaux à vacciner), et précautions nécessaires. - choix du vaccin le plus adapté (il existe souvent plusieurs vaccins contre une même maladie). - protocole de vaccination: âge à la primo-vaccination, nombre et fréquence des injections lors d'une primo-vaccination, rappels éventuels. |
| Le protocole de vaccination doit être défini rigoureusement, en fonction de la nature du vaccin, de l'objectif vaccinal, des indications et contre-indications à la vaccination. Il est important d'assurer la traçabilité des vaccinations (certificats et carnets) pour identifier les éventuels risques et échecs vaccinaux, et prévoir les rappels nécessaires. | |
| essai vaccinal | L'essai vaccinal permet d'évaluer l'efficacité théorique d'un vaccin en confrontant un groupe vacciné selon le protocole préconisé à une souche pathogène sauvage (souche virulente d'épreuve), par comparaison à un groupe témoin (qui reçoit, selon l'essai, une préparation sans antigène ou un vaccin de référence). La plupart des vaccins actuels présentent une efficacité théorique supérieure à 80% lors des essais vaccinaux en laboratoire; ces essais suivent des procédures standard et doivent se faire obligatoirement sur l'espèce cible. Les essais vaccinaux sur le terrain sont très rarement des essais complets: ils se contentent le plus souvent de vérifier que la réponse immune obtenue est similaire à celle obtenue chez les animaux de laboratoire. |
| types de vaccins | Le succès de la vaccination dépend à la fois de l'efficacité et de l'innocuité du vaccin disponible (impliquant un choix sur ces critères quand plusieurs vaccins sont disponibles). Ces 2 éléments sont fonction à la fois de la nature des antigènes retenus et de la formulation du vaccin. En particulier la formulation influence la qualité de l'immunité selon les voies de présentation des antigènes vaccinaux (réponse humorale/cellulaire, classes d'Ig produites). Un grand nombre de formulations ont été mises au point au cours du temps, et on peut les regrouper schématiquement en 3 principaux "types de vaccins", chacun subdivisés en plusieurs catégories (cf tableau 2: types de vaccins): - les vaccins vivants sont constitués de µorganismes non pathogènes et qui ont conservé un léger pouvoir d'infection temporaire. Il peut s'agir de souches homologues (issues de l'espèce microbienne qui cause la maladie) ou hétérologues (issues d'une espèce microbienne apparentée, mais exprimant des antigènes communs). La plupart des vaccins vivants sont élaborés à partir de souches avirulentes (ou très peu virulentes). Leur efficacité est souvent bonne, mais ce sont des vaccins fragiles et leur innocuité n'est pas toujours bonne. - les vaccins inactivés sont constitués de µorganismes qui ont subi un processus (inactivation) visant à bloquer leurs capacités d'infection et leur pouvoir pathogène, sans dénaturer les antigènes impliqués dans la protection. Leur innocuité est bonne, ils sont peu fragiles, mais leur efficacité est très variable d'un vaccin à l'autre. - les vaccins sous-unités sont constitués de fractions microbiennes (plus ou moins purifiées). Leur innocuité est très bonne, ils sont peu fragiles, mais leur efficacité est très variable. |
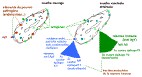
| atténuation | L'atténuation consiste à obtenir/sélectionner une souche vaccinale qui présente un pouvoir pathogène très diminué, voire complètement absent (avirulence), en profitant de la plasticité génétique des µorganismes. L'atténuation peut correspondre à de nombreux cas de figure (perte de synthèse d'enzymes impliqués dans la multiplication ou l'invasion, toxines mutées inactives..). Toutefois, les antigènes impliqués dans la réponse immune protectrice sont conservés sur la souche atténuée (soit sous leur forme native, soit sous une forme mutée qui n'a plus d'activité pathogène). (fig3: différences souche sauvage/atténuée et fraction immune protectrice) Les caractéristiques générales des infections s'appliquent aux souches vaccinales, et en particulier il est important de distinguer la pathogénicité selon l'espèce cible (une souche vaccinale hétérologue ou atténuée n'est pas virulente pour l'espèce de destination du vaccin, mais peut l'être pour d'autres espèces). |
| Quelques vaccins sont basés sur la découverte de souches spontanément avirulentes, qui ont été sélectionnées parmi les souches sauvages (=atténuation spontanée); mais ce cas est peu fréquent car ces souches restent mal connues et instables. La plupart des souches vaccinales actuelles proviennent d'une atténuation au laboratoire, et concernent des agents viraux (ces procédédés sont plus complexes en ce qui concerne les bactéries). De nombreuses techniques sont utilisées: - atténuation par passage en culture (quelle que soit la méthode de culture de l'espèce microbienne): des mutations réduisant le pouvoir pathogène sont favorisées grâce à des conditions de culture "anormales". L'avantage de cette méthode est le recul méthodologique, mais l'obtention de souches atténuées en culture peut être fastidieuse et aléatoire (plus de 5 ans pour l'atténuation du Bacille de Calmette et Guérin, BCG , 1921). Il existe de nombreux exemples; les 2 cas les plus connus sont: la modification de l'espèce-cible ("avianisation" des virus canins, c'est à dire adaptation à la culture sur cellules d'oiseaux, leur faisant perdre la capacité de multiplication dans des cellules canines), ou la modification de la température optimale ("mutants thermosensibles" des virus porcins, qui ne se multiplient pas à la température normale de l'espèce, mais nécessitent une température plus élevée de 2-4°C). - atténuation par mutation dirigée (par des méthodes traditionnelles ou par des méthodes de biologie moléculaire): les gènes impliqués dans le pouvoir pathogène sont modifiés ou supprimés de telle façon que la souche perde tout pouvoir pathogène. Par mesure de précaution, des modifications importantes sont effectuées dans le génome pour éviter une "réversion de la virulence". L'avantage de cette méthode est d'utiliser les connaissances scientifiques pour organiser une atténuation efficace et standardisée; l'inconvénient est que ces connaissances et techniques ne sont pas encore développées pour toutes les espèces microbiennes. |
|
| inactivation | L'inactivation consiste à bloquer complètement l'activité d'une souche microbienne (multiplication, mobilité, synthèse de toxines..) sans détruire ses constituants élémentaires (les structures protéiques sont intactes). L'inactivation est donc à distinguer clairement de la destruction, car les conformations antigéniques doivent être respectées au mieux pour assurer l'efficacité vaccinale (pas de perte d'épitopes par dépliement ou clivage!). L'inactivation est une méthode ancienne, et toujours très utilisée, car: - elle permet de produire des vaccins à partir de µorganismes qui ont conservé un pouvoir pathogène élevé (avant que des souches atténuées soient disponibles) - l'efficacité et l'innocuité sont généralement très bonnes (les vaccins inactivés présentent beaucoup moins de contre-indications) - les vaccins inactivés sont parfois les seuls autorisés, en ce qui concerne des maladies soumises à un contrôle réglementaire (rage) |
| Les procédés d'inactivation ont été mis au point dès les années 1920 (Ramon, 1923 vaccin anti-tétanique). La plupart des techniques reposent sur la formation de liaisons supplémentaires entre et à l'intérieur des protéines qui bloquent leur activité. L'inactivation est réalisée le plus souvent par un protocole standardisé de chauffage de la culture en présence d'agents oxydants (aldehydes, betapropiolactone..). L'inactivation peut se réaliser sur une culture microbienne brute (=anaculture), mais elle se fait plus souvent actuellement sur des µorganismes purifiés ou même sur des antigènes (=anatoxines). | |
| OGM vaccinal | Les techniques de biologie moléculaire ont pris en quelques années une place considérable dans la fabrication des vaccins, et de nombreuses méthodes ont été proposées: - expression d'un antigène protéique à partir d'une bactérie ou d'un virus recombinant (E.coli, canaripoxvirus, baculovirus d'insecte..) pour produire un vaccin "sous-unité" (cas le plus fréquent) ou pour produire un vaccin vivant (perspectives de recherche). Le choix du vecteur d'expression peut influencer la structure finale de l'antigène (glycosylation ou non, repliements..), et donc modifier les épitopes reconnus, ce qui explique la plus ou moins grande qualité de la réponse immune. Le choix du vecteur est essentiel si l'on envisage de l'administrer en tant que vaccin vivant, pour assurer une infection avirulente et de très courte durée (chez l'homme, la vaccine, la coqueluche ou les adénovirus sont les vecteurs les plus envisagés). - modification génétique d'une souche de l'agent infectieux (délétion de gènes impliqués dans le pouvoir pathogène) pour produire un vaccin vivant (vaccins herpesvirus porcins ou bovins). |
| anatoxine | = toxine purifiée à partir d'une culture puis inactivée (exemple: anatoxine tétanique). La vaccination par une anatoxine induit une réponse anticorps qui possède une forte activité neutralisante (conférant une protection très efficace). Ces anatoxines sont aussi utilisées pour immuniser des animaux producteurs d'antisérums. |
| composition d'un vaccin | Outre les antigènes/µorganismes vaccinaux, le vaccin contient un certain nombre d'éléments destinés à améliorer l'immunogénicité et la stabilité (cf tableau 2: composition générale d'un vaccin). La fabrication d'un vaccin est un processus très complexe qui est encadré par une réglementation pharmaceutique spécifique (adjuvants et conservateurs autorisés, libération des lots après contrôle de sécurité..). Les fabricants proposent régulièrement des "vaccins de nouvelle génération" pour améliorer l'efficacité, l'innocuité, la simplicité d'utilisation et le coût. |
| fragilité d'un vaccin | Comme tout produit biologique contenant des protéines, les vaccins sont considérés comme des produits fragiles: leur transport, leur conservation et leur utilisation doivent respecter des règles strictes. Ceci est d'autant plus vrai avec les vaccins vivants, qui contiennent des µorganismes qui doivent conserver leur pouvoir infectant (souvent faible par nature). Les vaccins doivent le plus souvent être conservés au froid (4°C) même lors des déplacements à domicile. |
| Différentes astuces sont proposées pour faciliter la conservation, tels que la lyophylisation. Certains vaccins vivants pour volialles sont même conservés dans l'azote liquide. Dans ces 2cas, la reconstitution du vaccin doit être extemporanée et respecter les procédures du fabriquant (nature de la solution de dilution, température..). | |
| adjuvant | = susbtance qui augmente l'immunogénicité d'un vaccin pour assurer une plus grande efficacité et une plus longue durée de protection. L'emploi d'un adjuvant peut être nécessaire, mais beaucoup d'adjuvants présentent des inconvénients (médiocre tolérance locale, réaction vaccinale..). Les vaccins qui contiennent des antigènes purifiés ont plus souvent besoin d'être adjuvés, pour fournir les signaux d'activation de la réponse immune (tandis que les vaccins contenant des µorganismes vivants ou des fractions de paroi microbienne n'ont pas besoin d'adjuvant). La qualité d'un vaccin se mesure en partie au choix de l'adjuvant. |
| Il existe de nombreux adjuvants commercialisés (plus d'une vingtaine), dont la pureté et les effets immunologiques sont plus ou moins définis (cf tableau2: composition d'un vaccin, fig 4 : principaux adjuvants). La plupart des adjuvants ont pour effet d'augmenter l'intensité de la réponse anticorps, mais certains adjuvants ont des actions plus ciblées sur la production de cytokines ou l'immunité cellulaire. Les adjuvants augmentent également la biodisponibilité des antigènes (durée de persistance au site d'injection..). Très généralement, l'adjuvant est intimement lié aux antigènes vaccinaux durant la fabrication, par des procédés d'adsorption ou d'émulsion (phases aqueuses/lipidiques). La formulation macro-moléculaire est un élément essentiel de la qualité du vaccin car elle contribue à la captation/activation des cellules présentatrices d'antigène. |
|
| valence d'un vaccin et associations vaccinales | La plupart des vaccins protègent contre un agent pathogène d'une espèce donnée (ou quelques espèces d'un même genre: leptospires): on parle de vaccin monovalent (une valence vaccinale=une maladie). Il est possible de combiner les vaccins pour protéger contre plusieurs agents infectieux en même temps, selon 2 principes opposés: - les vaccins polyvalents contiennent dès la fabrication des antigènes provenant de plusieurs agents infectieux (ex: DTP chez l'homme, CHPLR chez le chien, CHP chez le chat) |
| Les associations vaccinales doivent respecter des règles pour éviter un échec vaccinal: - les fabricants de vaccins polyvalents garantissent que l'immunité conférée pour chaque valence est la même que celle obtenue par une vaccination indépendante (beaucoup de vaccins des animaux domestiques sont des vaccins polyvalents). - plusieurs vaccins (monovalents ou polyvalents) ne doivent pas être mélangés dans une même seringue sauf autorisation expresse du fabricant. Les vaccins peuvent être détruits (sans que cela se voie!) quand il y a incompatibilité entre les adjuvants ou le pH des solutions. - Eventuellement, plusieurs vaccins peuvent être réalisés le même jour mais en réalisant plusieurs injections (vérifier les recommandations publiées). - certaines valences ne peuvent pas être associées car leur immunogénicité est faible (risque d'absence de réponse si une stimulation par un autre vaccin beaucoup plus immunogène est réalisé dans le même temps: ex piroplasmose canine..): ces vaccins doivent alors être faits en respectant un délai raisonnable (un mois). |
|
| dose vaccinale | Les vaccins sont administrés avec une dose identique quelque soit l'individu (pas de fractionnement pour un individu plus petit!). La quantité d'antigènes dans le vaccin est déterminée par le fabriquant pour assurer une réponse immune chez tous les individus vaccinés, sachant que l'immunité obtenue n'est pas proportionnelle à la concentration antigénique administrée. |
| La composition antigénique exacte des vaccins contenant des µorganismes entiers n'est pas connue, mais chaque vaccin fait l'objet d'une standardisation de la fabrication et de la dose (souche vaccinale identifiée, conditions de cultures définies, critères de qualité..). La dose peut s'exprimer en mg/ml ou UI d'antigènes, ou en quantité de µorganismes (dose exprimée en TCID50, PFU..). | |
| modalités de vaccination | De nombreuses voies d'administration ont été développées pour tenir compte des aspects scientifiques (type de vaccin) et pratiques (nombre d'individus à vacciner). La voie et le matériel préconisé par le fabricant assurent les conditions optimales d'efficacité et d'innocuité (toute modification est sous la responsabilité du vétérinaire praticien). |
| Il existe des protocoles de vaccination adaptés aux grands effectifs (élevages avicoles..), par exemple dans l'eau de boisson ou par brumisation. Ces protocoles doivent s'adresser à des groupes homogènes (âge..) et nécessitent une préparation (température des locaux, modification du système d'abreuvement..). Cependant, la vaccination collective ne permet pas d'attacher suffisamment d'importance à l'état clinique de chaque individu (risque vaccinal accru). | |
| auto-vaccin | = vaccin produit au cas par cas à partir de la souche pathogène présente dans un élevage. Il s'agit très généralement de vaccins contre des infections bactériennes (mammites, pneumonies..): l'isolement du germe en culture pure conduit à la fabrication du vaccin inactivé (il est nécessaire d'identifier correctement le germe pour estimer les chances de succès de l'auto-vaccin). Il ne faut pas négliger un risque vaccinal (exacerbation d'une maladie latente par la vaccination, réactions d'hypersensibilité..). Le vétérinaire doit jouer un rôle important pour décider de l'opportunité d'un auto-vaccin et pour déterminer un protocole de vaccination adapté (tout l'élevage? jeunes? femelles en début-milieu de gestation?durée de ce protocole?..). Cependant, la fabrication de ces vaccins se fait à une échelle artisanale, ce qui peut poser des problèmes de fiabilité et de sécurité (certains laboratoires le proposent comme prestation de service). |
schémas et figures | |
tableaux |
tableau 2: composition générale d'un vaccin |
nature | rôles | inconvénients |
| antigènes vaccinaux (µorganismes entiers ou fractionnés, ou antigènes purifiés) | très variable d'un vaccin à l'autre: |
essentiel: fraction immunogène spécifique | Les antigènes vaccinaux sont fragiles et peuvent facilement se dénaturer (clivage, changement de conformation), ceci d'autant plus qu'ils sont purifiés ou issus du génie génétique. |
| adjuvant | Un adjuvant peut entrer dans la composition du vaccin, mais ce n'est pas systématique (absence dans la majorité des vaccins composés de µorganismes entiers). Il existe plusieurs groupes d'adjuvants (le plus souvent employés seuls): - adjuvants mineraux (hydroxyde d'aluminium..): simple adsorption des antigènes - huiles minérales et dérivés: émulsions (non utilisés en médecine humaine car tolérance locale médiocre) - ISCOM (complexes immunostimulants lipidiques) et liposomes: véhicules de présentation des antigènes - composés d'origine microbienne (MDP..) et lectines: stimulateurs des cellules présentatrices d'antigène. De nombreux adjuvants en cours de développement sont dérivés de ce groupe. |
accroitre l'intensité et la qualité de la réponse immune et augmenter la biodisponibilité des antigènes | Ces éléments annexes du vaccin peuvent donner lieu à des effets indésirables: Ces effets indésirables peuvent être fréquents (irritation locale avec certains adjuvants) ou rares (réactions allergiques individuelles: cf cours HS1). |
| résidus du processus de fabrication/ stabilisateurs | La culture des µorganismes vaccinaux utilise des milieux de culture et des produits de fabrications (stabilisateurs, inactivateurs..) dont on retrouve une faible concentration dans le produit fini, en particulier des protéines (albumines..). Les résidus présents dépendent du type de culture employé pour la production microbienne (in ovo pour certains vaccins viraux, culture cellulaire en présence de sérum bovin..) |
néant (La quantité de ces produits est variable dans le vaccin selon le processus de fabrication/purification: élément du prix) | |
| conservateurs | quelques conservateurs sont autorisés dans la fabrication des vaccins. | augmenter la durée de conservation | |
| contaminants | indésirables! Le procédé de fabrication doit garantir l'absence de contaminants microbiens, et il existe des concentrations maximales autorisées pour les résidus toxiques (inactivateurs..). | ||
élements d'application et de raisonnement |
| La vaccinologie est la science de la vaccination. Certains aspects de la vaccination nécessitent en effet des travaux de recherche très complexes: - mise au point de vaccins contre des agents infectieux et parasites dotés de mécanismes d'échappement (paludisme, HIV..), ou susceptibles de causer des réactions immunopathologiques (leishmaniose..). - influence de la vaccination sur la prévalence de l'infection et la dynamique d'évolution des agents infectieux (épidémiologie) - analyses économiques et stratégiques sur la place de la vaccination dans la lutte contre les maladies infectieuses (comparaison prophylaxie médicale/sanitaire) |
| Il est quasi impossible d'établir si un individu donné sera protégé contre l'infection, car il faudrait pour cela mesurer chez cet animal précis sa réponse immune spécifique, pour y chercher des paramètres correlés avec la protection (taux d'anticorps neutralisants..). En particulier, le polymorphisme individuel du CMH influence considérablement l'immunogénicité des antigènes vaccinaux. La démarche d'analyse de l'immunité protectrice est en effet très complexe (ces tests ne sont pas réalisés à l'échelle individuelle, sauf dans les essais vaccinaux des dossiers d'AMM).: - identification des paramètres immuns corrélés avec la protection (variables selon le vaccin) et identification des taux considérés comme protecteurs (sachant que le taux d'anticorps sériques peut diminuer, sans perte de la protection, si des lymphocytes spécifiques restent stockés sous forme de lymphocytes mémoire dans les organes lymphoïdes). . - mesure de ces paramètres chez l'individu pour déterminer s'ils sont ≥ aux taux protecteurs. En particulier les éléments de l'immunité cellulaire nécessitent des techniques complexes et couteuses (dosage de la production d'IFN par les lymphocytes spécifiques..). Cette mesure devrait en outre être réitérée durant toute la durée de protection annoncée. La seule mesure mise en oeuvre en pratique est de vérifier si la vaccination a été correctement effectuée à l'aide de tests simples (intradermoréaction pour vérifier la réponse à la vaccination antituberculeuse CHEZ l'HOMME, mesure du taux d'anticorps après vaccination antirabique dans le cadre de la réglementation du transport international des carnivores). |
| L'efficacité réelle sur le terrain est évaluée le plus souvent de façon retrospective, avec toutes les difficultés statistiques que cela comporte (le % de malades chez les individus vaccinés doit être comparé avec le % de malades chez les non vaccinés, dans des conditions d'exposition similaires!). |
| Même si la vaccination est un acte individuel, elle doit s'envisager dans une optique collective et non pas individuelle: on parle de "couverture vaccinale". De nombreuses recherches vaccinales portent sur la modélisation épidémiologique de l'incidence et de la sévérité de l'atteinte en fonction du % d'individus vaccinés (cf revue "Vaccine"...). |
| La raison la plus fréquente d'échecs vaccinaux est la neutralisation du vaccin chez un jeune individu qui possède encore une grande quantité d'anticorps maternels (c'est le cas en particulier de la parvovirose canine). Plus la mère est immune (vaccinée..) et plus le jeune reçoit des anticorps, qui nécessitent donc de différer la vaccination, mais sans trop attendre non plus car il faut plusieurs jours pour que la vaccination soit effective. En pratique, on peut être amené à pratiquer une injection supplémentaire (3 au lieu de 2) pour tenir compte de ce risque d'échec lorsqu'on ne peut pas déterminer la période critique. |
| Chez le poulain issu d'une mère non immunisée contre le tétanos, il est préconisé de procéder à une injection de sérum antitétanique à la naissance pour assurer la protection néonatale, et de différer ensuite la vaccination à 4 mois au plus tôt. Le poulain issu d'une mère immunisée sera vacciné vers 2-3 mois (2 injections à 1 mois d'intervalle). |
| Le choix d'un type de vaccin dépend déjà de sa disponibilité pour l'infection considérée (la plupart des vaccins anti-bactériens sont des vaccins inactivés). A efficacité comparable, le vaccin le plus inoffensif doit être préféré (d'où le développement des vaccins sous-unités). |
| Atténuation des virus plus simple et plus stable que celle des bactéries |
| adjuvants classiques et adjuvants "modernes" (formulation) |
| développement des vaccins OGM considérables. Réglementation OGM: peu de vaccins vivants (diffusion) Choix de vecteurs pour la vaccination vétérinaire est complexe car chaque espèce domestique nécessite le développement de vecteurs spécifiques. Les recherches actuelles présentent surtout des stratégies fondées sur la modification génétique d'agents qui sont déjà des vaccins vivants, pour leur faire exprimer un antigène vaccinal supplémentaire provenant d'un autre µorganisme (création d'une valence supplémentaire). |
| recombinants versus vecteurs: inocuité versus immunisation préalable contre le vecteur |
| Rôle considérable des vétérinaires dans la création des premiers vaccins (cf archives Pasteur) |
références et cours disponibles |
cf cours de bactériologie (toxines, anatoxines et toxoides)
- "Veterinary Vaccinology", 1997 Elsevier, PP.Pastoret et al Editors, ISBN0-444-81968-1
- "vaccins traditionnels et vaccins recombinants", M.Eloit INRA Prod.Anim1998: http://www.inra.fr/internet/Produits/PA/an1998/num981/eloit/me981.htm
- "Childhood Vaccine Development: An Overview" J.P.Baker et al, Ped.Res 2004, 55/2: http://www.pedresearch.org/cgi/content/full/55/2/347
- "Transformation of a non-enzymatic toxin into a toxoid by genetic engineering" C.Fromen-Romano et al, Protein Engineering vol.10 no.10 pp.1213–1220, 1997: http://peds.oxfordjournals.org/cgi/reprint/10/10/1213
- http://www.pasteur.fr/infosci/archives/ram0.html
- http://www.pasteur.fr/infosci/archives/gue0.html
page réalisée par le Dr Delphine Grézel, VetAgro Sup, Campus Vétérinaire de Lyon, l5/12/11->-> . Merci pour les corrections, commentaires et suggestions ( delphine.grezel@vetagro-sup.fr)